
MRM Insights : Cibler l’OXPHOS dans les cellules souches de Gliome

Laura Raco

Dr Arezu Jahani-Asl
Chaque mois, dans les MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, Dr Arezu Jahani-Asl, chercheuse principale, et Laura Raco, candidate à la maîtrise dans son laboratoire, discutent du rôle de l’OXPHOS dans les cellules souches gliomales.
Cibler l’OXPHOS dans les cellules souches de Gliome
Depuis leur découverte, les cellules souches ont changé le cours de la science et de la médecine en repoussant les limites de ce que l’on croyait impossible. Leur capacité unique à générer divers types de cellules et de tissus dans tout le corps humain en a rapidement fait l’une des cellules les plus fascinantes et les plus complexes à étudier et à comprendre (Reya et coll. 2001, Zakrerski et coll. 2019). La régulation des cellules souches résulte de l’expression de programmes transcriptionnels et épigénétiques clés qui permettent à ces cellules de rester dans un état indifférencié. Bien que les mécanismes par lesquels ces programmes sont favorisés soient toujours un domaine de recherche en cours, il est clair que les signaux intrinsèques et extrinsèques du microenvironnement ont un rôle important à jouer dans la formation et le maintien de ces populations ainsi que dans le moment de la différenciation (Liebau et coll., 2016). Par exemple, on pense que la niche des cellules souches est un médiateur important dans le destin des cellules souches, c’est-à-dire que les cellules de niche protègent et permettent à l’homéostasie cellulaire de maintenir un équilibre d’auto-renouvellement et de différenciation. En outre, la régulation spatio-temporelle des cellules souches par rapport aux cellules de niche joue également un rôle important dans le statut et le nombre de cellules perpétuées (Moore & Lemishka 2006). Ajoutant à leur complexité de régulation, les cellules souches s’appuient sur différents mécanismes métaboliques pour assurer leur survie en fonction de l’état spécifique dans lequel elles se trouvent. Par exemple, les cellules souches pluripotentes (Pluripotent Stem Cells, PSC) naïves et se différenciant reposent fortement sur la phosphorylation oxydative (OXPHOS), tandis que les cellules souches pluripotentes amorcées régulent préférentiellement la glycolyse (Shyh-Chang & Ng 2017). À la lumière de cette complexité supplémentaire, il est cependant clair que le métabolisme mitochondrial est un moteur important de la survie et du devenir des cellules souches. Par exemple, la génération d’espèces réactives de l’oxygène (ROS), la production de métabolites de l’acide tricarboxylique (TCA), le métabolisme du pyruvate, le rapport NAD+/NAHD et la dynamique mitochondriale ont tous des rôles importants dans la régulation du devenir des cellules souches (Chakrabarty & Chandel 2021).
Au cours de la dernière décennie, le domaine de la science s’est tourné vers les cellules souches et les cellules ayant des propriétés souches pour la recherche sur le cancer. Les premières expériences ont fourni des preuves de la possibilité de l’occurrence des cellules de type souche dans la leucémie myéloïde aiguë (Lapidot et coll. 1994). Rapidement après que la preuve ait émergé que des cellules avec des propriétés similaires à celles des cellules souches, appelées cellules souches cancéreuses (CSC) ont également été identifiées dans les tumeurs solides (Singh et coll. 2004, Prince et coll. 2008, Al-Hajj et coll. 2003). Maintenant, les CSC sont considérés comme un élément clé dans la croissance du cancer, les métastases, la récidive et la résistance à l’intervention médicale. Ces cellules sont capables de générer des cellules différenciées et de maintenir le pool de cellules souches par division asymétrique et symétrique (Batlle et coll. 2017). Bien qu’il n’y ait pas de mécanisme définitif unique quant à la façon dont ces cellules cancéreuses spécialisées apparaissent, il est clair que la fonction mitochondriale a un impact significatif non seulement dans la progression du cancer, mais aussi dans l’apparition et le maintien des CSC (Vyas et coll. 2016).
Des recherches déjà établies dans le domaine du métabolisme dans les cellules cancéreuses suggèrent que les cellules cancéreuses dépendent fortement de la glycolyse. Il y a eu de nombreuses de propositions pour expliquer pourquoi ce processus pourrait avoir lieu et poser un avantage spécifique aux cellules cancéreuses mais depuis cette première observation, il y a eu des preuves que les cellules cancéreuses, y compris certaines avec des propriétés de type cellule souche, ne fonctionnent pas toutes de cette manière (Aston et autres 2018). Ceci est similaire aux PSC traditionnelles en ce qu’elles présentent différentes préférences métaboliques basées sur leur état ou leur identité (Shyh-Chang &Ng 2017). Grâce aux efforts de recherche sur le métabolisme au cours des dernières années, il a été montré que l’OXPHOS joue un rôle important dans la survie et la condition physique de certaines cellules souches cancéreuses (Yadav et coll., 2020). En 2020, Bonnay et coll. ont démontré que la phosphorylation oxydative est une caractéristique déterminante des cellules souches dérivées de tumeurs cérébrales de la drosophile. La régulation à la hausse de l’OXPHOS entraîne l’immortalisation des cellules souches neurales (Neural Stem Cells, NSC) et favorise un environnement propice à la tumorigenèse, tandis que le blocage de l’OXPHOS altère la formation de tumeurs (Bonnay et coll. 2020). Ce qui soutient davantage l’idée que l’OXPHOS peut jouer un rôle important dans les CSC de certains types de cancer. Valle et coll. 2020, ont décrit une méthode par laquelle les CSC dérivées de l’adénocarcinome canalaire pancréatique (Pancreatic Ductal Adenocarcinoma, PDAC) peuvent être maintenues et enrichies en culture par un passage forcé à l’utilisation de l’OXPHOS. Ils ont pu montrer que les CSC peuvent fonctionnellement nécessiter le métabolisme OXPHOS pour la chimiorésistance, l’évasion immunitaire, la régulation de la quiescence et les capacités d’auto-renouvellement (Valle et coll., 2020). L’importance de l’OXPHOS dans les CSC a également été démontrée dans les cancers tumoraux non solides tels que la leucémie myéloïde aiguë (Acute Myeloid Leukemia, AML). Le Mubritinib, un médicament précédemment identifié comme inhibiteur de l’ERRB2, s’est avéré se localiser dans les mitochondries des cellules souches leucémiques (Leukemic Stem Cells, LSC) où il inhibe fonctionnellement l’OXPHOS et induit un passage à la glycolyse dans un sous-ensemble distinct de cellules de l’AML ce qui représente un mauvais pronostic pour les patients. Ce médicament fonctionne en impactant la chaîne de transport d’électrons (Electron Transport Chain, ETC), en particulier en interagissant avec le Complexe I pour altérer la respiration mitochondriale. Après analyse des cellules sensibles au Mubritinib, les scientifiques ont pu évaluer que les LSC, en particulier celles issus d’un patient dont le pronostic est mauvais, sont plus sensibles et fortement corrélées à l’augmentation de l’expression des gènes liés à la respiration mitochondriale (Baccelli et coll., 2019).Dans le domaine des tumeurs cérébrales, il a été montré que les CSC dérivées de gliomes comptent fortement sur l’OXPHOS même en présence de substrat pour la glycolyse, suggérant que l’OXPHOS pourrait doter ces cellules avec d’avantages spécifiques de survie (Vlashi et coll., 2011). Avec un ensemble croissant de preuves suggérant que l’OXPHOS joue un rôle dans la tumorigenèse de divers types de cancers solides et hématopoïétiques, notre laboratoire a cherché à étudier le mécanisme de cette occurrence spécifiquement dans le glioblastome.
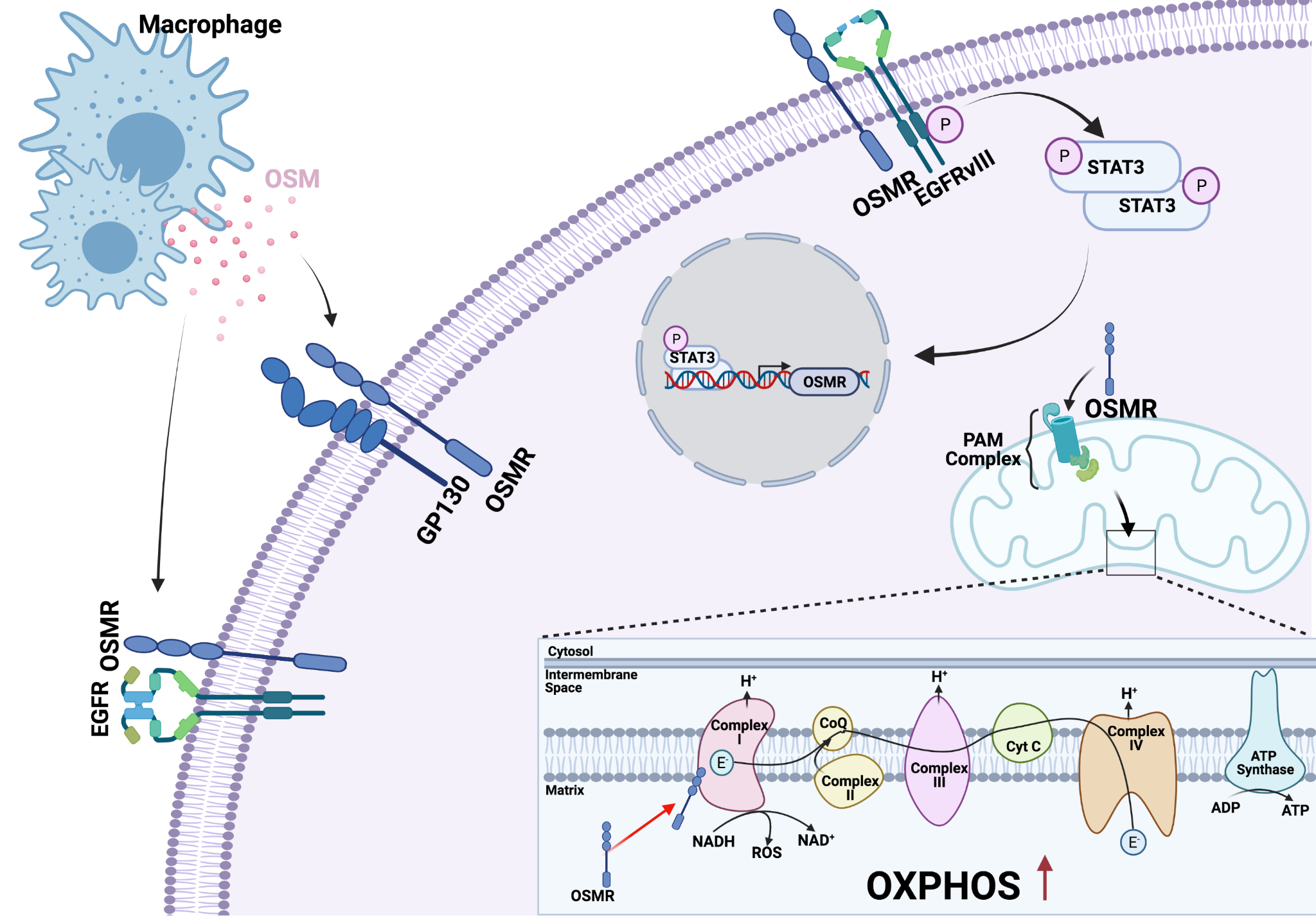
OSMR, un nouvel acteur clé dans la régulation de l’OXPHOS et la résistance des glioblastomes aux traitements.
Le glioblastome est l’un des types de cancer les plus agressifs et les plus mortels. Au cours de la dernière décennie, il y a eu d’innombrables efforts pour trouver de nouveaux traitements, mais les options de traitement précédemment établies consistant en la résection chirurgicale, la radiothérapie et la chimiothérapie sont toujours considérées comme la norme de soins à tous les niveaux. Pourtant, ces tumeurs présentent des niveaux élevés de récidive qui sont venus à être le centre des efforts de recherche actuels (Shergalis et coll., 2018). Le niveau élevé de récidive est souvent attribué à un petit sous-ensemble de cellules souches gliomales (Glioma Stem Cells, GSC) qui ont la capacité de propager de nouvelles formations tumorales même après une intervention médicale intense. Ajoutant à leur complexité, ces types de cellules se sont avérés être de nature hétérogène (Atashzar et coll., 2020). Récemment, notre laboratoire a identifié un acteur clé dans la régulation de l’OXPHOS dans les CSC dérivées de tumeurs du glioblastome (Sharanek et coll., 2020). Le récepteur M de l’oncostatine (OSMR) est un récepteur de cytokine qui a attiré plus d’attention ces dernières années. En 2016, notre laboratoire a découvert que l’OSMR fonctionne comme un acteur essentiel dans la progression du glioblastome grâce à une interaction directe avec l’EGFRvIII oncogène dans les cellules souches de tumeurs cérébrales humaines (brain tumor stem cells, BTSC) et les astrocytes murins. Cette interaction induit la phosphorylation de STAT3 dans les BTSC qui à son tour favorise l’expression de l’OSMR, générant ainsi efficacement une boucle de rétroaction positive contribuant à la tumorigenèse. Un knockdown d’OSMR in vivo et in vitro a atténué la prolifération des CSC et la croissance de tumeur et a prolongé la durée de vie souris ayant reçu une xénogreffe. Fait important, l’analyse de la base de données des patients a révélé que l’expression élevée de l’OSMR est significativement corrélée avec un mauvais pronostic pour les patients (Jahani-Asl et coll., 2016).
Dans des études de suivi, nous avons récemment découvert que l’OSMR est dirigé vers les mitochondries où, après translocation dans la matrice mitochondriale, il interagit avec le complexe I de la chaîne de transport d’électrons (ETC) pour favoriser la respiration des BTSCs. Cette découverte est venue en examinant les mécanismes par lesquels OSMR contribue à la tumorigenèse du glioblastome en dehors de son rôle de co-récepteur EGFRvIII. Son interaction spécifique avec NDUFS1 et NDUFS2 du complexe I a permis de formuler l’hypothèse que l’OSMR avait un impact fonctionnel sur l’ETC. D’autres expériences ont en fait montré que l’OSMR avait un impact sur la respiration mitochondriale de sorte qu’en présence de l’OSMR, les CSC ont un niveau significativement plus élevé de consommations d’oxygène, ce qui indique l’idée que l’OSMR peut réguler l’OXPHOS dans cette population. Un knockdown de l’OSMR, a diminué l’OXPHOS et a induit une redirection vers la glycolyse. Enfin, notre laboratoire a été en mesure de démontrer que la dépendance du cerveau à l’égard de l’OXPHOS a également un impact sur la sensibilité cellulaire aux rayonnements ionisants (IR), de sorte que ces cellules présentent des ROS plus élevés et une sensibilité plus élevée à l’IR dans les lignées cellulaires de knockdown OSMR (Sharanek et coll., 2020). Ces données soulignent l’importance de l’OXPHOS dans les GCS en particulier et suggèrent une méthode potentielle dans laquelle des populations hétérogènes de GSC/CSC peuvent être identifiées en fonction des moteurs des fonctions métaboliques clés.
Bien que le ciblage spécifique de l’OXPHOS directement par le biais d’inhibiteurs du cancer ait soulevé certaines questions concernant la toxicité pour les cellules voisines ainsi que pour les cellules immunitaires clés (Weiss 2020), l’identification et le ciblage des acteurs clés de l’OXPHOS ouvrent de nouvelles voies pour des interventions thérapeutiques potentielles convergeant vers les mitochondries. Nos découvertes récentes proposent un modèle selon lequel le ciblage de l’OSMR, combiné aux normes de soins actuelles, peut avoir un grand potentiel thérapeutique pour atténuer la résistance des CSC et des tumeurs à l’IR. Il est important de souligner que, plus récemment, il a été démontré que la cytokine OSM, produite par les macrophages, interagissait avec son récepteur OSMR sur les cellules cancéreuses pour activer STAT3 et induire la transition des cellules de glioblastome vers des états de type mésenchymateux (Hara et coll. 2021). Ainsi, les thérapies ciblant OSMR peuvent être prometteuses pour contrôler le microenvironnement immunitaire, moduler le métabolisme des CSC, et supprimer des commandes prédictives des CSC et des types de tumeurs qui s’appuient sur la signalisation EGFRvIII/STAT3 pour l’invasivité.
Références
Reya, T. et al. Stem cells, cancer and cancer stem cells. Nature 414 105-111 (2001)
Zakrzewski, W. et al. Stem cells: past, present and future. Stem Cell Res. Ther. 10, 68 (2019).
Liebau, S. et al. Factors regulating stem cell biology in development and disease. Stem Cells Int. 7170642 (2016)
Moore, K.A. & Lemischka, I.R. Stem cells and their niches. Science 311, 1880-1885 (2006)
Shyh-Chang, N. & Ng, H.H. The metabolic programming of stem cells. Genes Dev. 31, 336-346 (2017).
Chakrabarty, R.P & Chandel, N.S. Mitochondria as signaling organelles control mammalian stem cell fate. Cell Stem Cell 28, 394-408 (2021)
Lapidot, T. et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature 367, 645-468 (1994).
Singh, S.K. et al. Identification of human brain tumour initiating cells. Nature 432, 396–401 (2004).
Prince, M.E.P. et al. Cancer stem cells in head and neck squamous cell cancer. J. Clin. Oncol. 26, 2871-2875 (2008).
Al-Hajj, M. et al. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. USA 100, 3983–3988 (2003).
Batlle , E. et al. Cancer stem cells revisited. Nat Med. 23 1124-1134 (2017).
Vyas, et al. Mitochondria and cancer. Cell 166, 555-566 (2016).
Liberti, M.V. & Locasale J.W. The Warburg effect: How does it benefit cancer cells? Trends Biochem Sci. 41, 211-218 (2016).
Ashton, T.M et al. Oxidative phosphorylation as an emerging target in cancer therapy. Clin. Cancer Res. 24, 2482-2490 (2018)
Yadav, U.P. et al. Metabolic adaptations in cancer stem cells. Front. Oncol. 10, 1010 (2020).
Bonnay, F. Oxidative metabolism drives immortalization of neural stem cells during tumorigenesis. Cell 182, 1490-1507 (2020)
Valle, S. et al. Exploiting oxidative phosphorylation to promote stem and immunosuppressive properties in pancreatic stem cells. Nat. Commun. 11, 5262 (2020).
Baccelli, I. et al. Mubritinib targets the electron transport chain complex I and reveals the landscape of OXPHOS dependency in acute myeloid leukemia. Cancer Cell 36, 84-99 (2019).
Vlashi, E. et al. Metabolic state of glioma stem cells and nontumorigenic cells. Proc. Natl. Acad. Sci. USA 108, 16062-16067 (2011).
Shergalis, A. et al. Current challenges and opportunities in treating glioblastoma. Pharmacol Rev. 70, 412-445 (2018).
Atashzar, M.R. et al. Cancer stem cells: A review from origin to therapeutic implications. J. Cell. Physiol. 235, 790-803 (2020).
Sharanek, A. et al. OSMR controls glioma stem cell respiration and confers resistance of glioblastoma to ionizing radiation. Nat. Commun. 11, 4116 (2020).
Jahani-Asl, A. et al. Control of glioblastoma tumorigenesis by feed-forward cytokine signaling. Nat Neurosci. 19, 798-806 (2016).
Weiss, J.M. The promise and peril of targeting cell metabolism for cancer therapy. Cancer Immunol. Immunother. 69, 255-261 (2020).
Hara, et al. Interaction between cancer cells and immune cells drive transition to mesenchymal-like states in glioblastoma. Cancer Cell 39, 779-792 (2021)
