MRM Insights: Comment les cellules souches intestinales se joignent à la lutte contre le COVID-19

Dr. Alexander Gregorieff
Chaque mois, dans MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, le Dr. Alexander Gregorieff, Professeur adjoint au Département de pathologie de l’IR-CUSM et membre du Comité exécutif du MRM, explique comment les cellules souches intestinales se joignent à la lutte contre le COVID-19.
Comment les cellules souches intestinales se joignent à la lutte contre le COVID-19.
La COVID-19 est apparue ces derniers mois comme la question la plus urgente de santé publique et sociale dans le monde. Bien que les estimations actuelles des taux de mortalité demeurent contestées, la maladie causée par le SRAS-CoV-2 va de symptômes grippaux légers à la détresse respiratoire aigüe et à la défaillance de plusieurs organes. L’accumulation des preuves suggère que les réponses hyper-inflammatoires conduisent à des dommages étendus de tissu observés dans les cas graves de COVID-19 1. Cependant, les raisons pour lesquelles certaines personnes développent des réponses immunitaires exacerbées face à ce nouveau coronavirus restent incertaines. Une équipe de recherche dirigée par le Dr. Irah King de l’IR-CUSM et récemment financée par l’Initiative interdisciplinaire en infection et immunité (MI4) de McGill propose que les microbes vivant dans nos tripes puissent être des facteurs déterminants dans le développement de la COVID-19.
Le cas des microbes intestinaux.
Bien que particulièrement caractérisé par des complications respiratoires aiguës et progressives, plusieurs rapports indiquent maintenant que la COVID-19 est étroitement associée aux symptômes gastro-intestinaux (GI), y compris la nausée et la diarrhée 2,3. Fait important, la présence du SRAS-Cov-2 a été constatée dans les échantillons de selles et les biopsies de muqueuses intestinales des personnes infectées, même en l’absence d’échantillons pulmonaires positifs 4. Bien qu’aucune évidence des dommages intestinaux étendus de tissu n’ait été rapportée dans les patients de COVID-19, ces résultats tôt impliquent l’intestin comme probablement un composant clé modulant la sévérité de la maladie.
Le microbiote intestinal (une collection de bactéries, virus, champignons et archées) est essentiel pour une absorption efficace des nutriments et du métabolisme énergétique, mais donne également le « ton » inflammatoire des organes extra-intestinaux 5. En conséquence, il a été établi que le microbiote intestinal a des fonctions réglementaires puissantes pendant l’infection virale pulmonaire 6. Inversement, l’amélioration de la diversité du microbiote intestinal entraîne une diminution de la morbidité et de la mortalité à la suite d’un défi mortel contre la grippe 7. Conformément à ces études, les travaux de collaboration antérieurs de l’équipe du Dr King et des laboratoires des Drs Maziar Divangahi et Jeff Xia de l’Université McGill ont montré que la modulation du microbiote intestinal a des effets frappants sur la résistance de l’hôte à l’infection à mycobacterium tuberculosis 8. Sur la base de ces résultats, ces chercheurs se penchent maintenant sur la question de savoir s’il existe un lien similaire entre le microbiote intestinal et les réponses immunitaires de l’hôte au SRAS-CoV-2.
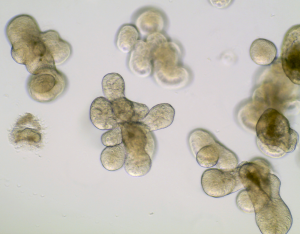
Photo Credit: Dr. Tanvi Anil Javkar
Modélisation COVID-19 in a dish.
Comme première étape pour percer ce mystère, King et ses collègues souhaitent étudier si l’infection par le SRAS-CoV-2 affecte la réponse antimicrobienne innée de l’épithélium intestinal. En effet, la paroi épithéliale intestinale sert de barrière redoutable contre les agents pathogènes grâce à son puissant arsenal de facteurs sécrétés qui neutralisent les envahisseurs bactériens potentiels. Dans le même ordre d’idées, un rapport précédent a montré que le récepteur de l’entrée du SRAS-CoV-2 dans la cellule (c.-à-d. ACE-2) est exprimé abondamment sur les cellules épithéliales du tractus gastro-intestinal et la perte de ce récepteur chez la souris est liée à la dysbiose microbienne et aux réponses régénératrices défectueuses dans l’intestin 9. Afin de répondre à cette question, l’équipe du Dr King, en collaboration avec le Dr. Alex Gregorieff (IR-CUSM), mettra au point un système d’organoïdes intestinaux humains pour modéliser l’infection par le SRAS-CoV-2 dans l’intestin.
Les organoïdes sont des systèmes de culture cellulaire quasi physiologique maintenus par des cellules souches spécifiques aux tissus dans un microenvironnement 3D qui présentent une fonctionnalité d’organe similaire à leur tissu d’origine 10. Les organoïdes ont été largement utilisés pour faire la lumière sur le comportement des cellules souches adultes dans la santé et la maladie, ainsi que pour étudier comment les agents pathogènes courants tels que le norovirus, l’hélicobacter pylori et même les parasites entériques interagissent avec l’épithélium intestinal 11-13. Plus récemment, il y a eu une course pour exploiter les organoïdes pulmonaires, endothéliaux, rénaux et hépatiques pour étudier l’impact du SRAS-CoV-2 sur ces tissus 14-16. Fait important, les organoïdes se sont également avérés être des modèles puissants pour tester de nouvelles thérapies visant à bloquer la capacité du SRAS-CoV-2 à infecter les cellules 15. L’équipe de recherche de l’IR-CUSM prévoit que ses études utilisant des organoïdes à base de cellules souches révéleront un aperçu important de cette maladie dévastatrice et aideront à déterminer si l’écosystème intestinal devrait être ciblé dans le cadre d’un plan de traitement complet pour lutter contre la pandémie de COVID-19.
Références :
1. Blanco-Melo, D. et al. Imbalanced hostresponse to SARS-CoV-2 drives development of COVID-19. Cell (2020). doi:DOI: 10.1016/j.cell.2020.04.026
2. Gu, J., Han, B. & Wang, J. COVID-19: Gastrointestinal Manifestations and Potential Fecal-Oral Transmission. Gastroenterology (2020). doi:10.1053/j.gastro.2020.02.054
3. Pan, L. et al. Clinical characteristics of COVID-19 patients with digestive symptoms in Hubei, China: a descriptive, cross-sectional, multicenter study. Am. J. gastrology Pre-proof (2020).
4. Xiao, F. et al. Evidence for Gastrointestinal Infection of SARS-CoV-2. Gastroenterology (2020). doi:10.1053/j.gastro.2020.02.055
5. Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome. Nature 486, 207–14 (2012).
6. Ichinohe, T. et al. Microbiota regulates immune defense against respiratory tract influenza A virus infection. Proc. Natl. Acad. Sci. U. S. A. 108, 5354–9 (2011).
7. Rosshart, S. P. et al. Wild Mouse Gut Microbiota Promotes Host Fitness and Improves Disease Resistance. Cell 171, 1015-1028.e13 (2017).
8. Khan, N. et al. Intestinal dysbiosis compromises alveolar macrophage immunity to Mycobacterium tuberculosis. Mucosal Immunol. 12, 772–783 (2019).
9. Hashimoto, T. et al. ACE2 links amino acid malnutrition to microbial ecology and intestinal inflammation. Nature 487, 477–81 (2012).
10. Fatehullah, A., Tan, S. H. & Barker, N. Organoids as an in vitro model of human development and disease. Nat. Cell Biol. 18, 246–54 (2016).
11. Wilke, G. et al. A Stem-Cell-Derived Platform Enables Complete Cryptosporidium Development In Vitro and Genetic Tractability. Cell Host Microbe 26, 123-134.e8 (2019).
12. Ramani, S., Crawford, S. E., Blutt, S. E. & Estes, M. K. Human organoid cultures: transformative new tools for human virus studies. Curr. Opin. Virol. 29, 79–86 (2018).
13. Pompaiah, M. & Bartfeld, S. Gastric Organoids: An Emerging Model System to Study Helicobacter pylori Pathogenesis. Curr. Top. Microbiol. Immunol. 400, 149–168
14. Zhu, N. et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N. Engl. J. Med. 382, 727–733 (2020).
15. Monteil, V. et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell (2020). doi:DOI: 10.1016/j.cell.2020.04.004
16. Zhao, B. et al. Recapitulation of SARS-CoV-2 infection and cholangiocyte damage with human liver ductal organoids. Protein Cell (2020). doi:10.1007/s13238-020-00718-6
