
MRM Insights: Y a-t-il un rôle pour la thérapie cellulaire dans l’infection par le SRAS-CoV-2?

Dr. Michel L. Tremblay

Dr. Inés Colmegna
Chaque mois, dans MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, Dr. Inés Colmegna, Professeur Associé à la Division de rhumatologie à l’IR-CUSM et membre du Comité Exécutif du MRM s’est associée au Dr. Michel L. Tremblay, Professeur dans le Départment de Biochime au Centre de recherche sur le cancer Goodman et directeur du Réseau MRM pour se poser cette question : Y a-t-il un rôle pour la thérapie cellulaire dans l’infection par le SRAS-CoV-2?
Y a-t-il un rôle pour la thérapie cellulaire dans l’infection par le SRAS-CoV-2?
L’impact de la pandémie actuelle est sans précédent et a changé les gens, les sociétés et le monde en général. Il y a un besoin urgent d’approches qui se sont avérées valides et qui peuvent modifier le cours naturel de l’infection. Y a-t-il un rôle pour la thérapie cellulaire dans ce paradigme ?
Sur le plan clinique, la COVID-19 peut être subdivisée en trois phases de sévérité croissante1 (Fig.1). Le stade I, caractérisé par une infection précoce avec des symptômes légers; le stade II, défini par une implication pulmonaire sans (IIa) ou avec (IIb) hypoxie; et le stade III (critique), marqué par l’hyperinflammation systémique1. Dans l’ensemble des études, 80 % des cas sont bénins, 14 % graves et 5 % sont critiques. Dans les cas critiques, le taux de létalité approche de 50 %2.
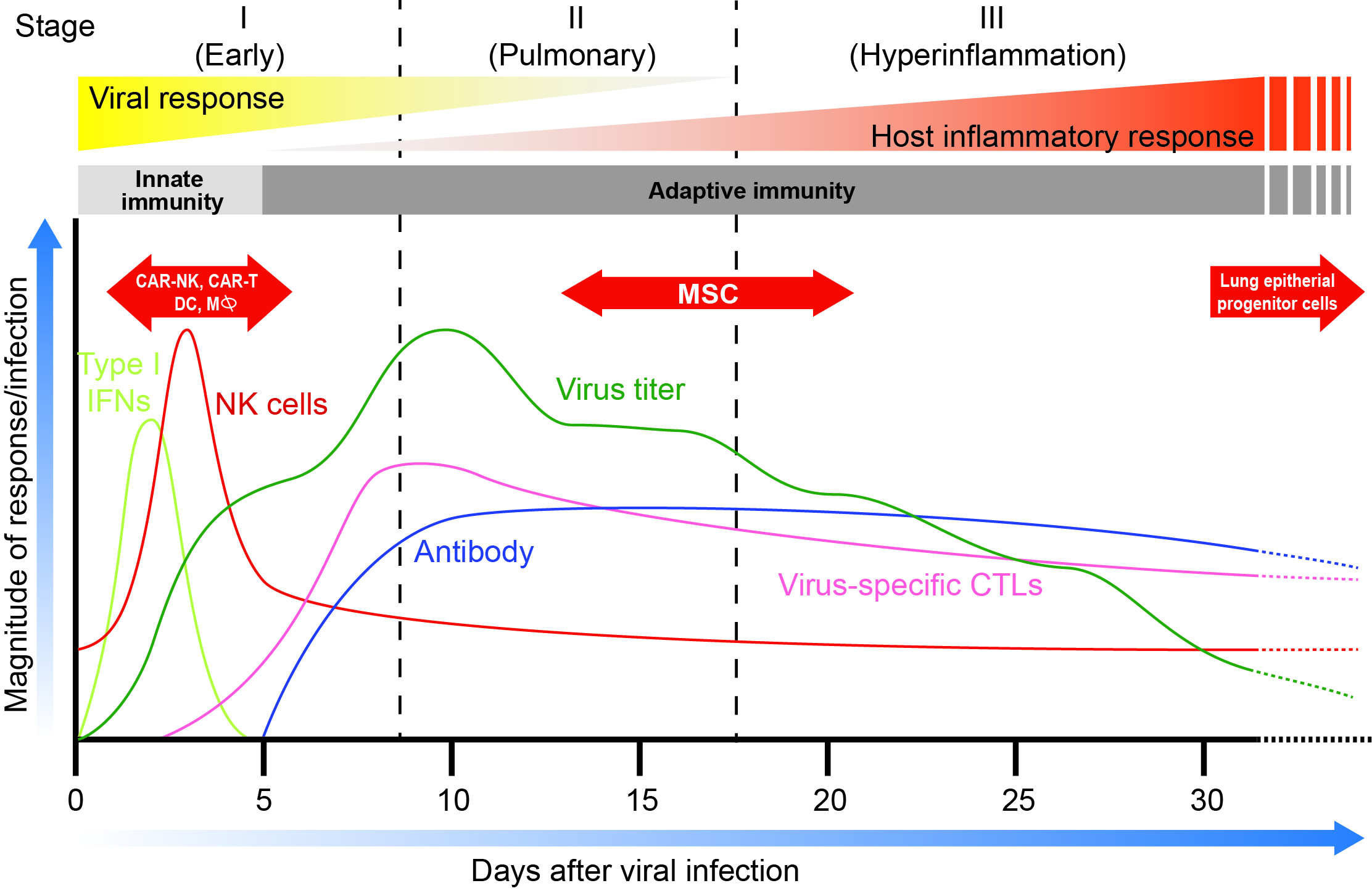
Figure 1. Profil dépendant du temps des étapes principales de l’infection du patient de la COVID avec les cellules immunitaires correspondantes du patient et les niveaux d’anticorps ANTI-COVID. En rouge sont les périodes optimales de traitements de thérapie cellulaire pour diverses immunothérapies cellulaires. Adapté de Siddiqi et al. (REF.1). Notez que les niveaux de « Titre viral » sont basés sur un article récent de Carmo et al. J. Med. Virol. June 2, 2020 (REF 26)
Pathogéniquement, la réponse de l’hôte est un déterminant clé de l’évolution de la COVID-19. Les niveaux accrus d’IL-6, Ferritin, D-dimer, Toponin I et ceux réduits de lymphocyte prédisent la mortalité3. Ces dispositifs sont partagés par les « syndromes de tempête de cytokine », un groupe de conditions dans lesquelles l’hyperinflammation et la défaillance de plusieurs organes résultent de la libération excessive de cytokine due à une activation immunitaire incontrôlée4. Cela justifie l’existence des essais cliniques en cours évaluant l’innocuité et l’efficacité des stratégies de blocus de la cytokine, y compris la modulation de l’IL-1, de l’IL-6 et de l’IFNγ et d’autres (Tableau 1). Une approche alternative actuellement étudiée pour les syndromes de tempête de cytokine est l’administration systémique des cellules stromales mésenchymales multipotentes (MSC)5,6.

Tableau 1: Traitements actuels et potentiels de la COVID. Source: Dr. Inés Colmegna et Dr. Michel L. Tremblay
Les MSC sont des cellules progénitrices multipotentes aux propriétés immunomodulatrices, pro-angiogéniques et anti fibrotiques7. Les sources les plus courantes de MSC utilisées dans les essais cliniques sont la moelle osseuse (BMMSC), le tissu adipeux (ATMSC) et le cordon ombilical (UCMSC). Au Canada, l’utilisation de BMMSC est approuvée pour la greffe aiguë réfractaire pédiatrique en rapport à la maladie hôte8. Les MSC montrent des niveaux intermédiaires de molécules humaines d’antigène leucocyte (HLA) de classe I et n’ont pas de niveaux détectables de classe II de HLA, y compris HLA-DR, ni de molécules co-stimulantes (CD40, CD80 et CD86)9. Ce phénotype permet leur utilisation allogénique8. Dans les modèles animaux, après une administration en intraveineuse, la plupart des UCMSC sont emprisonnées dans les poumons et sont rapidement retirées de la circulation (demi-vie de 24 heures)10. Ceci est particulièrement pertinent car les poumons sont l’organe cible principal du COVID-19. Dans les poumons, les UCMSC infusées sont rapidement phagocytées par les monocytes classiques et les macrophages alvéolaires résidents de tissu qui polarisent vers un phénotype anti-inflammatoire M2 (par exemple la mort programmée via express ligand-1 et IL-10)11. Les monocytes amorcés par les UCMSC induisent la formation réglementaire de cellules T amplifiant et prolongeant les effets anti-inflammatoires des MSC10. Un autre mécanisme impliqué dans les rôles anti-inflammatoires et trophiques (p. ex., l’inhibition de l’apoptose, de l’angiogenèse) des MSC est la sécrétion de facteurs de croissance, de cytokines et d’hormones (p. ex., VEGF, PDGF, ANG-1, IL-11, PGE2, TSG-6, SDF-1, HGF, IGF-1, IDO), particules membranaires, mitochondries et vésicules extracellulaires12-14. La production de ces médiateurs est améliorée par des cytokines pro-inflammatoires, y compris l’interféron-MD (IFN-MD), TNF-MD, IL-17 et IL-1-15. Comme indiqué plus tôt, ces facteurs sont élevés dans les patients présentant la COVID-19 et ainsi, pourrait amorcer l’infusion d’UCMSC, améliorant leurs effets thérapeutiques. Ceci justifie le développement de plus de 20 essais cliniques basés sur les MSC contre la COVID-19 qui sont enregistrés dans ClinicalTrials.gov. Les données antérieures dans d’autres contextes de maladie et les données limitées spécifiquement dans le cadre de la COVID-19 appuient l’innocuité de cette approche16,17,18. Quatre essais randomisés, contrôlés par placebo et de phase 2/3 porteront sur le rôle des MSC comme traitement pour la COVID. Le Tableau 2 résume les principales caractéristiques et les principaux résultats de ces essais.
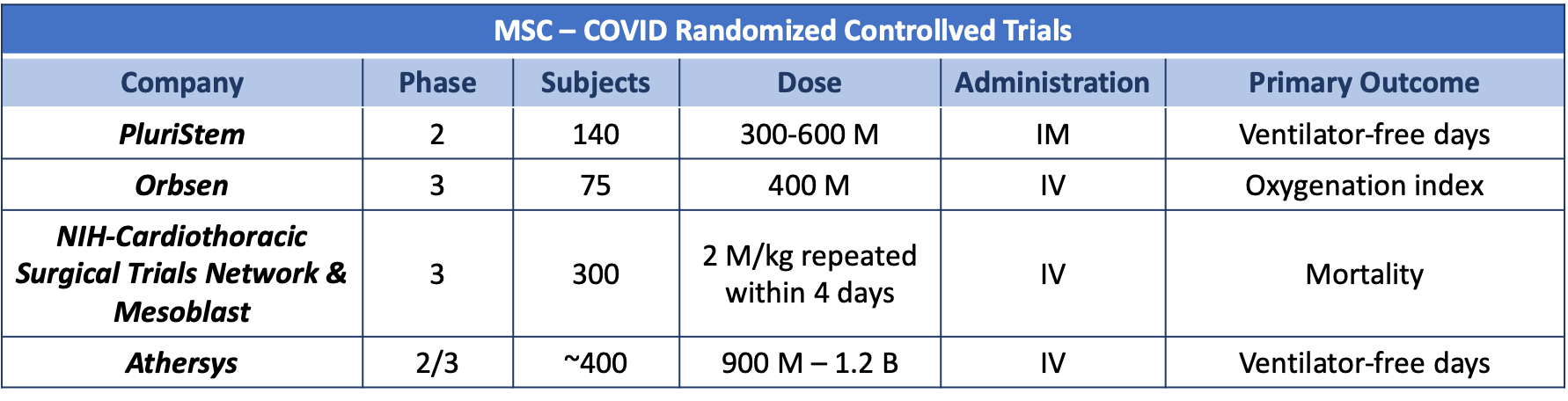
Tableau 2: M: million; B: billion; IM: intramuscular, IV: intravenous Sources: Dr. Inés Colmegna et ClinicalTrials.gov
En plus des MSC, d’autres approches thérapeutiques cellulaires pourraient potentiellement être utilisées chez les patients atteints de la COVID-19 à haut risque de résultats indésirables. Parmi ceux-ci, le transfert de cellules immunitaires tels que CAR-T, déjà utilisé dans le cancer 19 et d’autres maladies infectieuses 20, pourrait être utilisé pour éliminer directement les cellules infectées virales ou pour améliorer la réponse immunitaire précoce innée avant que la gravité de l’infection par le SRAS-CoV-2 ne devienne écrasante. Par exemple, l’infusion cellulaire autologue de cellules dendritiques activées de façon exogène ou même des macrophages activés M1 présentant des antigènes coronavirus spécifiques peut aider les patients les plus vulnérables à réduire leur charge virale. De même, les cellules tueuses naturelles modifiées par les récepteurs chimériques (CAR-NK) peuvent être utilisées pour cibler les cellules infectées. Il est important de considérer que de telles approches de thérapie cellulaire devraient être essayées tôt dans l’infection ; comme une fois qu’une réponse inflammatoire grave est établie (phase II), les cellules immunitaires activées (génétiquement modifiées ou non) peuvent conduire à des résultats plus graves. Un autre stade auquel la thérapie cellulaire peut également être bénéfique dans la COVID-19 est pour les personnes qui se sont rétablies de l’infection (post-phase III) et ont des dommages fibrotiques épithéliaux épithéliaux permanents 21. À la sortie, 90 % des patients atteints de COVID ont une maladie pulmonaire résiduelle détectée par CT 22. Certains auteurs ont proposé la post-infection pour employer des thérapies antifibrotiques afin de réduire au minimum les dommages pulmonaires à long terme 23. Alternativement, pour les patients plus sévèrement affectés, le transfert des cellules progénitrices épithéliales de poumon peut être une option thérapeutique potentielle qui exige d’être examinée dans des essais cliniques 24. Cette approche a également été proposée pour la grippe et les coronavirus 25.
Y a-t-il un rôle pour la thérapie cellulaire dans l’infection par le SRAS-CoV-2 ? En se basant sur la compréhension actuelle de la pathogénie de la COVID-9 et la connaissance mécaniste antérieure des approches de thérapie cellulaire, il est tentant de spéculer que cela pourrait être possible. Cependant, ce n’est qu’à travers des essais cliniques bien conçus que l’efficacité de ces approches pour la COVID devrait être testée. Ces études bénéficieront d’être associées à des données mécanistes dans ce modèle spécifique de maladie et d’avoir des critères spécifiques de sélection des patients. Comme dans toutes les autres conditions, il est irréaliste de s’attendre à un type de solution « unique ». En revanche, l’application des connaissances antérieures et les tester rigoureusement dans cette nouvelle maladie permettra d’identifier des solutions pour alléger le fardeau de la pandémie et de promouvoir le rétablissement des patients touchés.
Références:
1. Siddiqi HKM, M.R. COVID-19 illness in native and immunosuppressed states: A clinical−therapeutic staging proposal. The Journal of Heart and Lung Transplantation 2020; 39(5): 405-7.
2. Wu Z, McGoogan JM. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72314 Cases From the Chinese Center for Disease Control and Prevention. JAMA 2020.
3. Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020; 395(10229): 1054-62.
4. Henderson LA, Canna SW, Schulert GS, et al. On the Alert for Cytokine Storm: Immunopathology in COVID-19. Arthritis Rheumatol 2020.
5. Swart JF, de Roock S, Nievelstein RAJ, Slaper-Cortenbach ICM, Boelens JJ, Wulffraat NM. Bone-marrow derived mesenchymal stromal cells infusion in therapy refractory juvenile idiopathic arthritis patients. Rheumatology (Oxford) 2019; 58(10): 1812-7.
6. Saldana L, Bensiamar F, Valles G, Mancebo FJ, Garcia-Rey E, Vilaboa N. Immunoregulatory potential of mesenchymal stem cells following activation by macrophage-derived soluble factors. Stem Cell Res Ther 2019; 10(1): 58.
7. Spees JL, Lee RH, Gregory CA. Mechanisms of mesenchymal stem/stromal cell function. Stem Cell Res Ther 2016; 7(1): 125.
8. Galipeau J, Sensebe L. Mesenchymal Stromal Cells: Clinical Challenges and Therapeutic Opportunities. Cell Stem Cell 2018; 22(6): 824-33.
9. Le Blanc K, Tammik C, Rosendahl K, Zetterberg E, Ringden O. HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells. Exp Hematol 2003; 31(10): 890-6.
10. de Witte SFH, Luk F, Sierra Parraga JM, et al. Immunomodulation By Therapeutic Mesenchymal Stromal Cells (MSC) Is Triggered Through Phagocytosis of MSC By Monocytic Cells. Stem Cells 2018; 36(4): 602-15.
11. de Witte SFH, Merino AM, Franquesa M, et al. Cytokine treatment optimises the immunotherapeutic effects of umbilical cord-derived MSC for treatment of inflammatory liver disease. Stem Cell Res Ther 2017; 8(1): 140.
12. Ferreira JR, Teixeira GQ, Santos SG, Barbosa MA, Almeida-Porada G, Goncalves RM. Mesenchymal Stromal Cell Secretome: Influencing Therapeutic Potential by Cellular Pre-conditioning. Front Immunol 2018; 9: 2837.
13. Hoogduijn MJ, Lombardo E. Mesenchymal Stromal Cells Anno 2019: Dawn of the Therapeutic Era? Concise Review. Stem Cells Transl Med 2019; 8(11): 1126-34.
14. Morrison TJ, Jackson MV, Cunningham EK, et al. Mesenchymal Stromal Cells Modulate Macrophages in Clinically Relevant Lung Injury Models by Extracellular Vesicle Mitochondrial Transfer. Am J Respir Crit Care Med 2017; 196(10): 1275-86.
15. Noronha NC, Mizukami A, Caliari-Oliveira C, et al. Priming approaches to improve the efficacy of mesenchymal stromal cell-based therapies. Stem Cell Res Ther 2019; 10(1): 131.
16. Leng Z, Zhu R, Hou W, et al. Transplantation of ACE2(-) Mesenchymal Stem Cells Improves the Outcome of Patients with COVID-19 Pneumonia. Aging Dis 2020; 11(2): 216-28.
17. Matthay MA, Calfee CS, Zhuo H, et al. Treatment with allogeneic mesenchymal stromal cells for moderate to severe acute respiratory distress syndrome (START study): a randomised phase 2a safety trial. Lancet Respir Med 2019; 7(2): 154-62.
18. Schijns V, Lavelle EC. Prevention and treatment of COVID-19 disease by controlled modulation of innate immunity. Eur J Immunol 2020.
19. David Pettitt 1, Zeeshaan Arshad 2, James Smith 3, Tijana Stanic 4, Georg Holländer 5, David Brindley . CAR-T Cells: A Systematic Review and Mixed Methods Analysis of the Clinical Trial Landscape. Mol Ther. Feb 7;26(2):342-353. 2018 doi: 10.1016/j.ymthe.2017.10.019. Epub 2017 Nov 2.
20. Kaeuferle T, Krauss R, Blaeschke F, Willier S, Feuchtinger T. Strategies of adoptive T -cell transfer to treat refractory viral infections post allogeneic stem cell transplantation .J Hematol Oncol. Feb 6;12(1):13. 2019 doi: 10.1186/s13045-019-0701-1.PMID: 30728058.
21. Paolo Spagnolo, Elisabetta Balestro, Stefano Aliberti, Elisabetta Cocconcelli, Davide Biondini, Giovanni Della Casa, Nicola Sverzellati, Toby M Maher Pulmonary Fibrosis Secondary to COVID-19: A Call to Arms? Lancet Respir Med 2020 Published Online May 15, 2020 https://doi.org/10.1016/ S2213-2600(20)30222-8
22. Yuhui Wang*, Chengjun Dong, Yue Hu, Chungao Li, Qianqian Ren, Xin Zhang, Heshui Shi, Min Zhou Temporal Changes of CT Findings in 90 Patients with COVID-19 Pneumonia: A Longitudinal Study. RADIOLOGY Published Online:Mar 19 2020 https://doi.org/10.1148/radiol.2020200843
23. Peter M George, Athol U Wells, R Gisli Jenkins Pulmonary fibrosis and COVID-19: the potential role for antifibrotic therapy Lancet Respir Med 2020 PublishedOnline May 15, 2020 https://doi.org/10.1016/ S2213-2600(20)30225-3
24. William J. Zacharias, David B. Frank, Jarod A. Zepp, Michael P. Morley, Farrah A . Alkhaleel, Jun Kong, Su Zhou, Edward Cantu and Edward E. Morrisey. Regeneration of the lung alveolus by an evolutionarily conserved epithelial progenitor. Nature 8 m a r c h VO L 5 5 5 | | 2 5 1-273.
25. Jiang Du , Han Li , Jie Lian , Xinxing Zhu , Liang Qiao and Juntang Lin. Stem cell therapy: a potential approach for treatment of influenza virus and coronavirus-induced acute lung injury Stem Cell Research & Therapy (2020) 11:192 https://doi.org/10.1186/s13287-020-01699-3
26. Anália Carmo, João Pereira-Vaz , Vanda Mota, Alexandra Mendes, Célia Morais, Andreia Coelho da Silva, Elisabete Camilo, Catarina Silva Pinto, Elizabete Cunha , Janet Pereira, Margarida Coucelo, Patrícia Martinho, Lurdes Correia, Gilberto Marques, Lucília Araújo, Fernando Rodrigues . Clearance and Persistence of SARS-CoV-2 RNA in COVID-19 Patients.. J Med Virol Jun 2. 2020 doi: 10.1002/jmv.26103. Online ahead of print. PMID: 32484958
