MRM Insights : L’ascension, la chute… Et le retour des organoïdes cérébraux

Dr. Thomas Durcan
Chaque mois, dans MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, le Dr. Thomas Durcan, Professeur adjoint au Département de Neurologie et neurochirurgie au Neuro, Directeur associé de la Plateforme de découverte de médicaments en phase précoce (PDMPP) et membre du Comité exécutif du MRM, nous parle du chemin qui nous a conduits aux organoïdes cérébraux et ce que l’avenir leur réserve.
L’ascension, la chute… Et le retour des organoïdes cérébraux
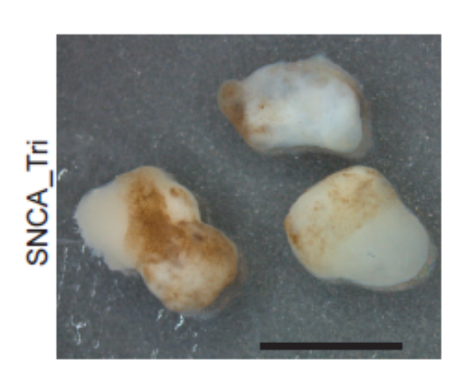
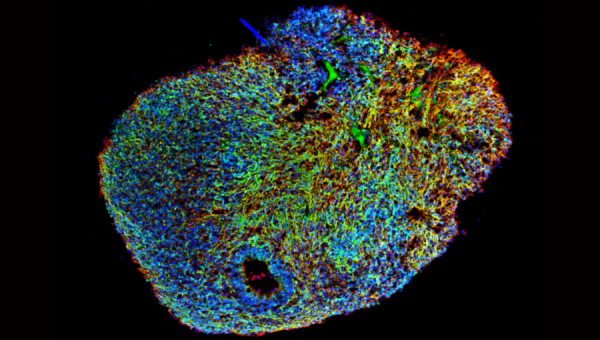
Figure 1 : Organoïdes de mésencéphale, dérivés de cellules iPSC humaines, cultivés pendant 6 mois (avec la permission du Dr. Nguyen Vi Mohamed, PDMPP, le Neuro)
Le mardi 9 janvier 2007, Steve Jobs est monté sur la scène du Moscone Convention Centre à San Francisco, pour l’événement annuel MacWorld où il a dévoilé le tout premier iPhone. À partir de ce moment, il a changé nos vies, catapultant Apple en devenant l’une des entreprises les plus prospères dans le monde. En outre, cela entraîna l’un des plus grands renversements de fortune, en réussissant à passer d’une société au bord de la faillite à un phénomène mondial. Alors pourquoi mentionner cela Tom ? N’est-ce pas là un aperçu de la médecine régénérative et des cellules souches ? Eh bien oui, vous avez raison, mais tout le monde aime une bonne histoire de rédemption. Des humbles débuts, au succès, les critiques redescendent, le battage médiatique s’estompe, l’obscurité s’invite, puis voilà, la réinvention de Taylor Swift et le prochain gros phénomène débarque et prend de plus en plus d’ampleur. Des musiciens aux boxeurs, en passant par les acteurs, les politiciens et les entreprises comme Apple, chacun a ses propres histoires de rédemption, comment ils sont revenus de leurs cendres, se sont réinventés et sont revenus plus forts que jamais. Pour moi, en tant que scientifique, quand je pense à une histoire récente de rédemption, les organoïdes cérébraux (ou comme on les appelle souvent, les Minicervaux) me viennent à l’esprit, et je vais expliquer ici pourquoi (Figure 1).
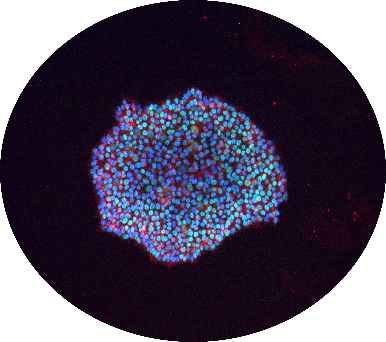
Figure 2 : Image représentative de cellules souches pluripotentes humaines induites (iPSCs) (avec la permission du Dr. Carol Chen, PDMPP, le Neuro)
Alors que 2007 a été une année phare pour les smartphones, c’est aussi l’année où le Dr. Shinya Yamanaka a publié ses travaux fondateurs sur les cellules souches pluripotentes humaines induites (iPSC) (Figure 2) 1, fournissant aux chercheurs les outils nécessaires pour générer n’importe quel type de cellules à partir de ces cellules. En outre, cela signifiait que pour la première fois, une génération de chercheurs en neurosciences pourrait générer des neurones humains in vitro, ce qui permet de générer des cellules adéquates pour des maladies correspondant à un trouble neuronal donné, comme des neurones moteurs pour la sclérose latérale amyotrophique (SLA), des neurones dopaminergiques pour la maladie de Parkinson (PD), ou des neurones corticaux pour les troubles du spectre autistique (Figure 3). C’est donc à partir de 2007 que nous avons pu modéliser ces troubles et identifier les thérapies potentielles avec ces cellules 2, mais ce n’est qu’en 2013 que le plein potentiel des iPSC a été atteint pour les troubles du système nerveux central (SNC).
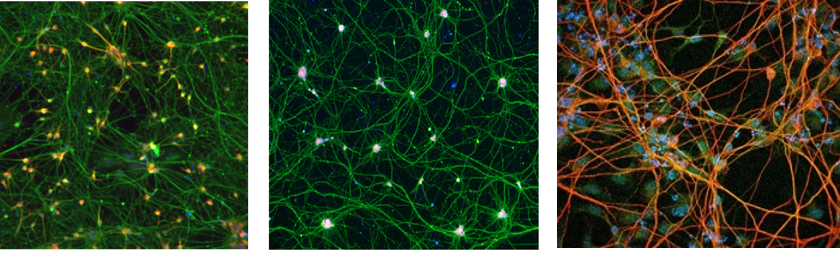
Figure 3 : Image représentative de neurones dopaminergiques (à gauche), de neurones moteurs (au centre) et de neurones corticaux (à droite) dérivés d’iPSCs (avec la permission d’Andrea Krahn (Dopaminergiques), du Dr. Mathilde Chaineau (Moteurs) et du Dr. Cecilia Rocha (Corticaux), PDMPP, le Neuro)
Le 28 août 2013, les travaux du Dr Madeline Lancaster ont été publiés 3, et pour la première fois, des iPSCs pourraient être utilisées pour cultiver des organoïdes cérébraux in vitro. Possédant un certain nombre de caractéristiques de la région corticale du cerveau, ils pourraient également reprendre les défauts développementaux associés à la microcéphalie. Une fois ce modèle sorti, le champ des organoïdes du cerveau a décollé, de la modélisation du virus Zika 4, au contrôle de la fonction musculaire 5, à l’approfondissement de notre compréhension de la façon dont le cerveau se développe 6 et propsant un nouvel outil pour modéliser les troubles neurodégénératifs 7,8, le potentiel de ces structures 3D était illimité. Ces structures neuronales 3D, au fur et à mesure leur croissance, développaient une activité neuronale semblable à celle observée avec un fœtus de 6 mois 9.
Mais c’est en 2018, en plein milieu de leur essor, que les premières fissures sont apparues pour les organoïdes cérébraux. Comme les modèles ont commencé à ressembler plus étroitement à un cerveau fœtal, des questions éthiques se sont posées quant à savoir si ces organoïdes du cerveau pourraient être sensibles 10. Mais les organoïdes cérébraux avaient un secret bien gardé, ils étaient en fait encore très différents du cerveau et ils étaient sous beaucoup de stress lorsqu’ils étaient cultivés in vitro 11. Au fur et à mesure qu’elles grandissaient, les cellules mouraient au cœur de l’organoïde de nécrose due à une faible disponibilité en nutriments et une mauvaise oxygénation, ce qui rendait difficile l’interprétation des données qui en découlaient. En outre, l’activation des voies de signalisation du stress a eu un impact sur la capacité de sous-types neuronaux spécifiques de se former, l’empêchant de recréer pleinement ce que nous observerions dans un cerveau humain en développement. Après tout le battage médiatique, le succès et la croissance de ce nouveau domaine sur une période relativement courte de sept ans, les questions tourbillonnaient autour de l’utilité des organoïdes cérébraux comme modèle : sont-ils aussi bons que nous le pensons ? Avons-nous perdu tout notre temps à travailler sur eux ? Et bien oui et non.
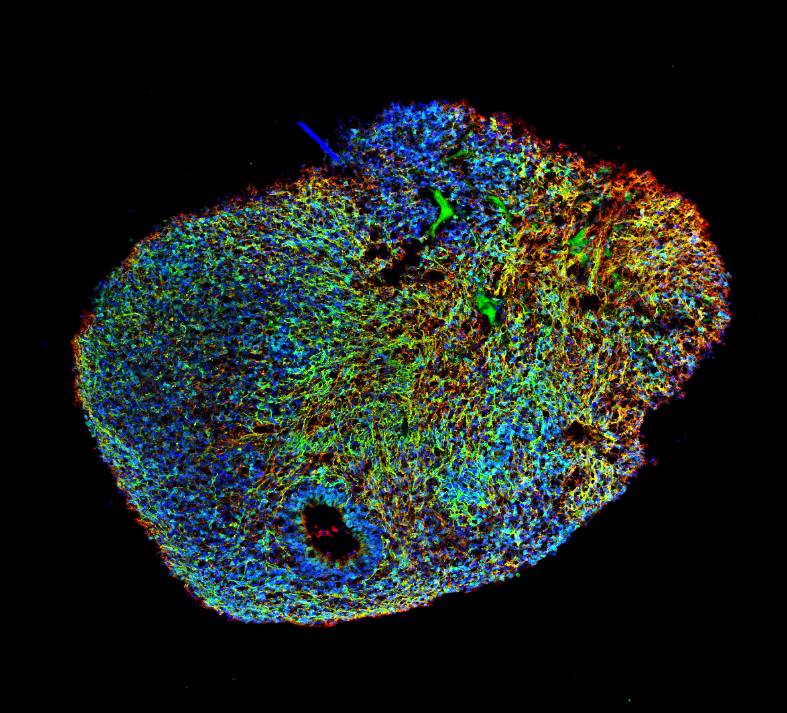
Figure 4 : Section d’un organoïde cérébral cultivé dans un bioréacteur (avec la permission du Dr. Nguyen Vi Mohamed, MBrainBio)
Vous souvenez-vous du premier iPhone, l’utilisez-vous toujours ? Bien sûr que non, de nouveaux modèles ont émergé et à chaque itération, les choses se sont améliorées, de nouvelles caméras, un assistant virtuel (Salut Siri, Salut Tom), de nouveaux écrans, une meilleure durée de vie de la batterie. C’est là où nous en sommes avec les organoïdes cérébraux. Nous avons vu les limites du modèle et, bien qu’il s’agisse d’un revers, c’est maintenant la version 2, et nous avons beaucoup plus de versions à suivre, amenant nombre d’opportunités uniques pour le domaine de croître et de se développer. Avec la micro-fluidique, le flux nutritif et l’oxygénation peuvent être améliorés pour réduire le stress, diminuant ainsi la mort cellulaire. D’autres caractéristiques sont également manquantes, des cellules immunitaires à la microglie en passant par la vascularisation, mais peu à peu, ces obstacles sont surmontés. Des études ont montré que les organoïdes peuvent être fabriqués avec des microglies 12; les chercheurs peuvent maintenant vasculariser les organoïdes 13. Non seulement cela, nous savons maintenant que les organoïdes cérébraux peuvent produire du liquide céphalo-rachidien 14, ouvrant de nouvelles possibilités pour identifier les biomarqueurs de la maladie, chose qui n’était pas possible avant. Avec la COVID-19, les organoïdes cérébraux ont été utilisés pour modéliser le virus, fournissant potentiellement un modèle pour expliquer comment le coronavirus affecte la fonction neuronale dans les cas graves 15. Tout comme Apple et l’iPhone, les organoïdes cérébraux peuvent être modifiés, améliorés et de nouvelles fonctionnalités peuvent être ajoutées à chaque itération. Au cours de la prochaine décennie, ce modèle a le potentiel de changer la façon dont nous comprenons et traitons les troubles du cerveau à jamais, et si les organoïdes du cerveau sont même deux fois moins réussis que l’iPhone l’a été, un futur où nous pouvons comprendre et traiter les troubles du cerveau ne sera pas loin derrière. Si cela s’avère vrai, les organoïdes cérébraux auront démontré leur résilience, rebondissant de leurs récents coups pour devenir l’une des véritables réussites de la prochaine décennie, et je suis pour ma part excité de voir ce qui vient ensuite pour l’humble Organoïde Cérébral (Figure 4).
Références:
1 Takahashi, K. et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 131, 861-872, doi:10.1016/j.cell.2007.11.019 (2007).
2 Wainger, B. J. et al. Intrinsic membrane hyperexcitability of amyotrophic lateral sclerosis patient-derived motor neurons. Cell Rep 7, 1-11, doi:10.1016/j.celrep.2014.03.019 (2014).
3 Lancaster, M. A. et al. Cerebral organoids model human brain development and microcephaly. Nature 501, 373-379, doi:10.1038/nature12517 (2013).
4 Qian, X. et al. Brain-Region-Specific Organoids Using Mini-bioreactors for Modeling ZIKV Exposure. Cell 165, 1238-1254, doi:10.1016/j.cell.2016.04.032 (2016).
5 Giandomenico, S. L. et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nature neuroscience 22, 669-679, doi:10.1038/s41593-019-0350-2 (2019).
6 Velasco, S. et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature 570, 523-527, doi:10.1038/s41586-019-1289-x (2019).
7 Ghatak, S. et al. Mechanisms of hyperexcitability in Alzheimer’s disease hiPSC-derived neurons and cerebral organoids vs isogenic controls. Elife 8, doi:10.7554/eLife.50333 (2019).
8 Smits, L. M. et al. Modeling Parkinson’s disease in midbrain-like organoids. NPJ Parkinsons Dis 5, 5, doi:10.1038/s41531-019-0078-4 (2019).
9 Trujillo, C. A. et al. Complex Oscillatory Waves Emerging from Cortical Organoids Model Early Human Brain Network Development. Cell Stem Cell, doi:10.1016/j.stem.2019.08.002 (2019).
10 Farahany, N. A. et al. The ethics of experimenting with human brain tissue. Nature 556, 429-432, doi:10.1038/d41586-018-04813-x (2018).
11 Bhaduri, A. et al. Cell stress in cortical organoids impairs molecular subtype specification. Nature 578, 142-148, doi:10.1038/s41586-020-1962-0 (2020).
12 Ormel, P. R. et al. Microglia innately develop within cerebral organoids. Nat Commun 9, 4167, doi:10.1038/s41467-018-06684-2 (2018).
13 Pham, M. T. et al. Generation of human vascularized brain organoids. Neuroreport 29, 588-593, doi:10.1097/WNR.0000000000001014 (2018).
14 Pellegrini, L. et al. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science 369, doi:10.1126/science.aaz5626 (2020).
15 Zhang, B.-Z. et al. SARS-CoV-2 infects human neural progenitor cells and brain organoids. Cell Research, doi:10.1038/s41422-020-0390-x (2020).
