MRM Insights – L’ingénierie ciblée de la lignée germinale : Où en est-on ?

Me. Erika Kleiderman
Chaque mois, dans MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, Me. Erika Kleiderman, Associée académique au Centre de génomique et politiques, membre du Comité exécutif du MRM et Présidente du Comité d’éthique MRM, nous parle de la longue et sinueuse route de l’ingénierie ciblée de la lignée germinale humaine.
L’ingénierie ciblée de la lignée germinale: Où en est-on ?
L’édition du génome humain apporte avec elle la possibilité de corriger ou de modifier l’ADN humain afin de traiter (et ultimement de prévenir) diverses maladies ou affections génétiques (NASEM 2017). Lorsqu’on discute de l’édition du génome humain, il y a une distinction importante à faire entre l’édition somatique (c.-à-d. que les modifications sont limitées à l’individu traité) et l’édition germinale (c.-à-d. des modifications héréditaires qui peuvent potentiellement être transmises aux générations futures). C’est l’édition germinale qui sera au centre de l’attention ici. L’édition somatique est jugée éthiquement acceptable et est réglementée par des directives existantes, liées aux thérapies cellulaires et géniques alors que l’édition germinale est considérée à la fois moralement et éthiquement litigieuse et est généralement interdite (c.-à-d. qu’elle ne devrait pas être utilisée dans un contexte clinique). Voir la figure 1 pour un résumé des principales distinctions entre les deux.
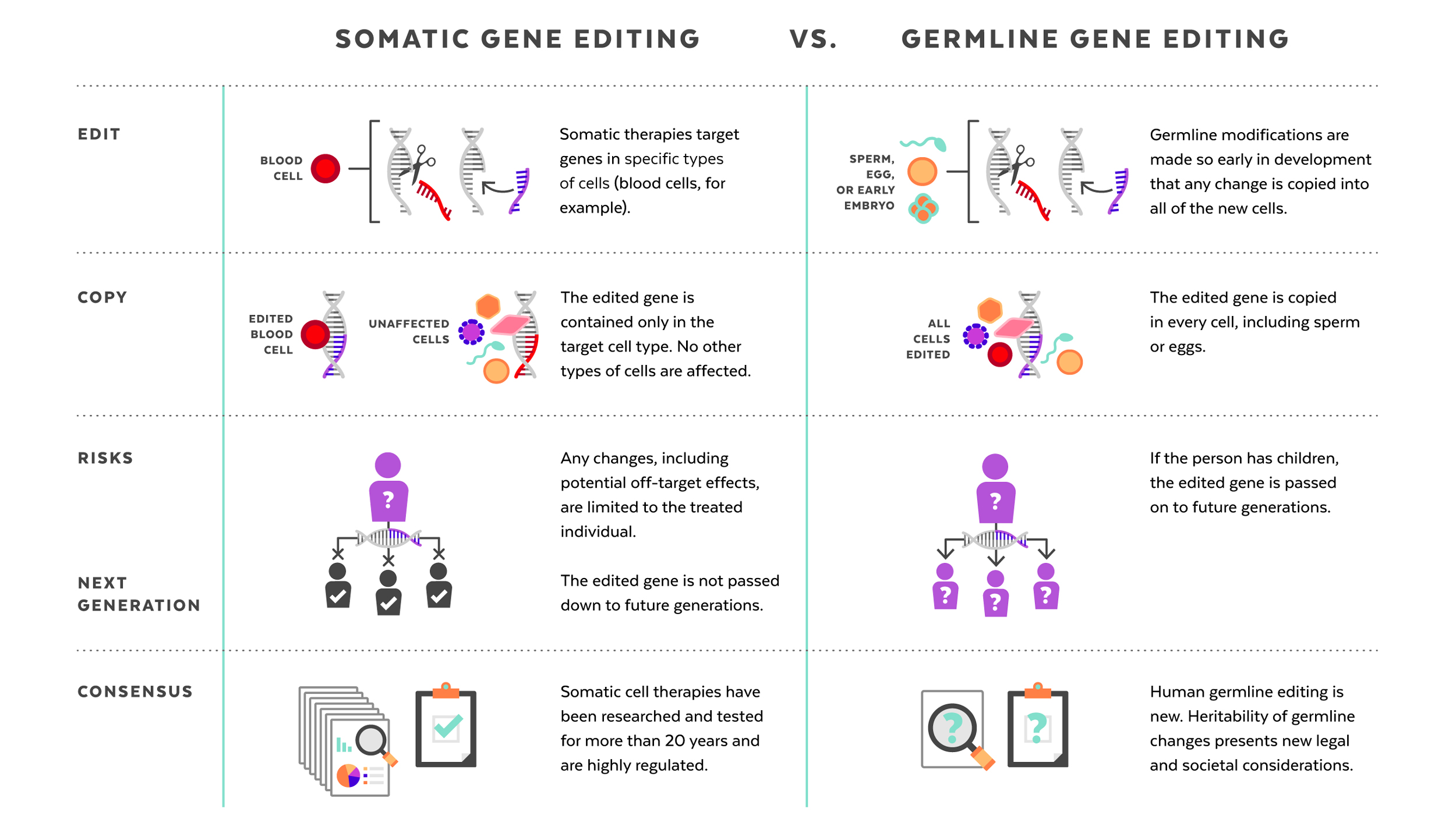
Figure 1. Résumé des distinctions clés entre l’édition du génome somatique et germinal. D’après la Harvard Gazette, Perspectives on gene editing.
L’ingénierie ciblée de la lignée germinale est au premier plan des débats éthiques nationaux et internationaux depuis l’avènement de CRISPR-Cas91 en 2015. Depuis 2015, plus de 61 communications et rapports sur l’éthique et les politiques ont été publiés par plus de 50 pays et organisations (Brokowski 2018). La plupart de ces rapports, en accord avec les lois et règlements nationaux, encouragent l’édition du génome somatique, tout en interdisant l’utilisation de l’ingénierie ciblée de la lignée germinale à des fins reproductives (Baylis et coll., 2020; Isasi et coll. 2016). En outre, l’appel à une large discussion sociétale (et, espérons-le, à un consensus éventuel) continue de prendre de l’importance à mesure que ces discussions passeront du domaine de l’élaboration des politiques à un plus large éventail d’intervenants et d’utilisateurs finaux. L’objectif étant d’élargir la portée des perspectives et des expériences au-delà des scientifiques, cliniciens, éthiciens et décideurs pour inclure ceux qui pourraient ou seraient le plus directement touchés par les progrès et les applications de cette technologie.
Afin de retracer l’évolution du débat sur la science et les politiques, j’offre ici un survol des événements clés et des rapports qui façonnent le débat depuis 2015.
Avril 2015:
La publication d’une étude chinoise (Liang et coll. 2015) qui a utilisé l’ingénierie ciblée de la lignée germinale des embryons humains non viables dans une tentative de traiter la β-thalassémie. Bien que l’étude n’ait pas été elle-même très réussie, elle a servi de catalyseur pour le débat international entourant CRISPR-Cas9 et son application dans les embryons humains.
Décembre 2015:
Le premier Sommet international sur la modification du génome humain s’est tenu à Washington, D.C. pour discuter des implications de l’utilisation de l’ingénierie ciblée de la lignée germinale dans les embryons humains. En fin de compte, il a été déterminé qu’« il serait irresponsable de procéder à toute utilisation clinique de l’ingénierie ciblée de la lignée germinale à moins que (i) les questions pertinentes en matière d’innocuité et d’efficacité n’aient été résolues, sur la base d’une compréhension et d’un équilibre appropriés des risques, des avantages potentiels et des solutions de rechange, et (ii) qu’il existe un large consensus sociétal sur la pertinence de la demande proposée » (Baltimore et coll., 2015). Par conséquent, l’application de l’ingénierie ciblée de la lignée germinale à des fins reproductives ne devrait pas être autorisée pour le moment.
Février 2016:
L’Human Fertilisation and Embryology Authority (Royaume-Uni) a accordé sa première licence de recherche à la Dre Kathy Niakan permettant l’utilisation de l’édition du génome sur des embryons humains sains dans un contexte de recherche (Callaway 2016). Le but de la recherche était de mieux comprendre la non-implantation et les fausses couches. Tous les embryons utilisés pour cette recherche ont été détruits conformément à la règle internationalement acceptée de 14 jours (Pera 2017). Des recherches similaires ont également été menées par le Dr Fredrik Lanner en Suède dans le but de développer une meilleure compréhension de l’infertilité, des fausses couches et des cellules souches embryonnaires humaines (Gallego 2016).
Février 2017:
La publication du rapport des National Academies of Sciences, Engineering and Medicine (NASEM) intitulé Human Genome Editing – Science, Ethics & Governance. Premièrement, le présent rapport indique que l’édition du génome à des fins de recherche devrait être autorisée, car elle est encadrée par les règlements existants. Deuxièmement, l’utilisation de l’édition du génome somatique dans le cadre d’essais cliniques devrait être autorisée, car les règlements et normes existants pour les thérapies cellulaires et géniques peuvent être appliqués pour assurer une surveillance adéquate. Troisièmement, l’utilisation de l’ingénierie ciblée de la lignée germinale dans le contexte d’essais cliniques ne peut être autorisée que pour le traitement et la prévention de maladies graves (p. ex., fins impérieuses), à condition que ces essais répondent à un ensemble de critères bien définis (p. ex., dernier recours, suivi multigénérationnel à long terme, engagement continu du public) et qu’un système de surveillance rigoureux soit en place. Quatrièmement, l’utilisation de l’édition du génome humain à d’autres fins que le traitement et la prévention des maladies (c.-à-d. l’amélioration humaine) devrait rester interdite pour le moment. Par conséquent, ce rapport est le premier à suggérer la possibilité que les applications cliniques de l’ingénierie ciblée de la lignée germinale puissent éventuellement être permises dans certaines circonstances et conditions.
Août 2017:
La publication d’une étude américaine, dirigée par le Dr Shoukhrat Mitalipov, qui a employé l’ingénierie ciblée de la lignée germinale dans une tentative de corriger une condition cardiaque sérieuse et héréditaire (Servick 2017 ; Ma et coll. 2017). Cette étude a été menée à l’aide d’embryons humains sains qui ont été détruits conformément à la règle des 14 jours. Considérée comme l’utilisation la plus « réussie » de la technologie pour corriger les gènes ciblés chez les embryons humains à ce jour, elle a mis en valeur le potentiel de réparer les mutations et de prévenir la transmission de maladies héréditaires. Cela a suscité beaucoup d’attention et d’enthousiasme dans les médias, tout en faisant mieux comprendre certaines des questions d’innocuité et d’efficacité entourant l’ingénierie ciblée de la lignée germinale. Cela dit, ces conclusions ne sont qu’un pas sur la longue et sinueuse route qu’il reste à parcourir.
Juillet 2018:
La publication du rapport du Nuffield Council on Bioethics intitulé Genome Editing and Human Reproduction – Social and Ethical Issues. Ce rapport indique que l’édition du génome n’est pas inacceptable en soi et qu’elle peut devenir moralement acceptable avec le temps. Néanmoins, le rapport stipule que si l’ingénierie ciblée de la lignée germinale est autorisée, elle doit être strictement réglementée (p. ex., par un organisme de réglementation) et devrait être autorisée seulement au cas par cas. La permissibilité de son utilisation dans le cadre d’essais cliniques devrait se limiter aux études qui ont élaboré un plan de surveillance à long terme des effets sur les individus et les groupes. Enfin, le rapport encourage également un débat sociétal large et inclusif sur les interventions sur la lignée germinale et les développements scientifiques et médicaux connexes. En ce sens, ce rapport commence à élaborer une voie responsable possible pour l’ingénierie ciblée de la lignée germinale avec des lignes directrices claires et supplémentaires.
Novembre 2018:
L’annonce de la naissance des « bébés CRISPR » (jumelles nommées Lulu et Nana) via une vidéo YouTube a été faite quelques jours seulement avant le deuxième Sommet international sur la modification du génome humain (Kolata, Wee et Belluck 2018). Le Dr Jiankui He, chercheur chinois en biophysique, a modifié génétiquement des embryons humains, puis les a implantés dans une femme à des fins reproductives. Comme nous l’avons vu, le consensus international affirme que les applications reproductives de l’ingénierie ciblée de la lignée germinale devraient rester interdites d’un point de vue éthique et scientifique. Non seulement cette utilisation à des fins reproductives était prématurée et irresponsable, mais l’essai clinique du Dr He avait de nombreuses lacunes du point de vue de l’éthique de la recherche pour ne rien dire des violations potentielles des règlements chinois et des normes internationalement acceptées (Krimsky 2019; Barrangou 2018). Ces manquements ont des répercussions directes sur l’intégrité de l’étude elle-même et sur la sécurité des participants. Cet événement a donné lieu à de nouveaux appels en faveur d’un moratoire sur l’ingénierie ciblée de la lignée germinale afin de s’assurer qu’une situation semblable ne se reproduise pas (Lander et coll., 2019; Adelman et coll. 2019). Pourtant, ce serait paradoxal, car il existe déjà des interdictions légales autour de l’ingénierie ciblée de la lignée germinale, de sorte qu’une voie plus réaliste serait de se concentrer sur le renforcement des lois, règlements et lignes directrices actuels, tout en encourageant le dialogue public participatif (Knoppers & Kleiderman 2019). Bien que le Dr He ait été condamné à trois ans de prison ainsi qu’à une amende importante, son cas a finalement été réduit à une pratique médicale illégale (c.-à-d. à la pratique de la médecine sans permis), ainsi qu’à l’interdiction de poursuivre la recherche dans le domaine des technologies de procréation assistée (Cohen et Normille, 2020; Johnston 2019). Enfin, les « bébés CRISPR » ont également conduit à des discussions sur la façon de prévenir les scientifiques malhonnêtes et quels mécanismes auraient pu encourager ceux qui connaissaient les plans du Dr He à le dénoncer (Charo 2019; Kofler 2019; Townsend 2020).
Novembre 2018:
Le deuxième Sommet international sur la modification du génome humain s’est tenu à Hong Kong pour discuter des perspectives éthiques et culturelles, des risques et des avantages potentiels de l’édition du génome humain, des considérations réglementaires et politiques, ainsi que des efforts d’engagement du public. Les résultats de la discussion portent sur la proposition « d’une voie translationnelle vers l’édition germinale [qui] exigera l’adhésion à des normes largement acceptées pour la recherche clinique, y compris des critères énoncés dans les documents d’orientation sur l’édition du génome publiés au cours des trois dernières années. Une telle voie exigera l’établissement de normes pour les preuves précliniques et l’exactitude de la modification génétique, l’évaluation des compétences des praticiens des essais cliniques, des normes exécutoires de comportement professionnel et des partenariats solides avec les patients et les groupes de défense des droits des patients » (Baltimore et al., 2018). Pendant tout ce temps, la recherche sur l’édition du génome humain devrait continuer d’être encouragée afin de favoriser une meilleure compréhension de l’innocuité et de l’efficacité de la technologie. Enfin, il y a eu une envie de continuer à encourager une discussion au niveau international déjà en cours, qui est devenue un fil conducteur tout au long du débat sur l’ingénierie ciblée de la lignée germinale. Pourtant, l’opérationnalisation et la logistique d’un tel forum restent à déterminer.
Décembre 2018:
L’Organisation mondiale de la Santé (OMS) a créé son Comité consultatif d’experts sur l’élaboration de normes mondiales pour l’encadrement et la surveillance de l’édition du génome humain. L’objectif de ce Comité est d’élaborer un cadre de gouvernance mondiale solide et complet pour la gérance responsable de l’édition du génome humain (Reardon 2019). En outre, le Comité a également demandé et établi un nouveau registre mondial des essais cliniques utilisant l’édition du génome humain (Chaib 2019; Cohen 2019). Ce registre comprend des essais cliniques utilisant l’édition du génome humain sur des ovules, des spermatozoïdes et des embryons précoces (lignée germinale), ainsi que sur des cellules adultes (somatiques). En début 2020, il y a eu une consultation en ligne du Projet de cadre de gouvernance pour l’édition du génome humain. Le cadre final devrait être lancé dans les prochains mois.
Mai 2019:
La National Academy of Medicine, la National Academy of Sciences et la Royal Society ont créé la Commission internationale sur l’utilisation clinique de l’édition héréditaire du génome humain. L’objectif de cette Commission était « d’élaborer un cadre à l’étude pour les scientifiques, les cliniciens et les autorités réglementaires lors de l’évaluation des applications cliniques potentielles de l’édition du génome de la lignée germinale humaine. Le cadre identifiera un certain nombre d’exigences scientifiques, médicales et éthiques qui devraient être prises en considération, et pourraient éclairer le développement d’une voie potentielle de la recherche à l’utilisation clinique – si la société conclut que les applications héréditaires d’édition du génome humain sont acceptables » (NASEM 2019).
Juin 2019:
Un biologiste moléculaire russe, le Dr Denis Rebrikov, a annoncé son intention de suivre les pas du Dr He et d’utiliser l’ingénierie ciblée de la lignée germinale pour créer des bébés résistants au VIH, mais d’une manière plus éthique qu’auparavant. Depuis cette annonce, les plans du Dr Rebrikov sont passés de la résistance au VIH à l’édition des embryons de couples atteints d’un type spécifique de surdité héréditaire afin de créer des bébés entendants. Toutefois, le ministère de la Santé de la Fédération de Russie a affirmé en octobre 2019 que l’utilisation de l’ingénierie ciblée de la lignée germinale dans un tel contexte était prématurée et qu’il approuvait la position de l’OMS selon laquelle il serait irresponsable et inacceptable d’utiliser des embryons dont le génome a été modifié pour initier des grossesses humaines en ce moment (Cyranoski 2019).
Novembre 2020:
La publication du rapport de la Commission internationale sur l’utilisation clinique du rapport final d’édition héréditaire du génome humain intitulé Heritable Human Genome Editing: Consensus Study Report. Ce rapport soutient que les applications reproductives de l’ingénierie ciblée de la lignée germinale ne devraient pas se poursuivre tant que l’innocuité et l’efficacité de CRISPR n’auront pas été prouvées, tout en appelant à poursuivre les efforts visant à établir un large dialogue sociétal sur la question. Tout comme d’autres rapports, la Commission n’a pas exclu la possibilité d’utiliser l’ingénierie ciblée de la lignée germinale; toutefois, celle-ci nécessitera une validation scientifique plus approfondie par la collecte de données précliniques (c.-à-d. encourager la recherche). De plus, des critères strictement définis et une surveillance rigoureuse seront également exigés de pour toute utilisation éventuelle de l’ingénierie ciblée de la lignée germinale, et de telles utilisations devraient être présentées progressivement. En outre, la Commission propose la création d’un Comité consultatif scientifique international (International Scientific Advisory Panel, ISAP) chargé de superviser toute utilisation clinique de l’ingénierie ciblée de la lignée germinale. Les membres du ISAP posséderaient une expertise et une expérience diversifiées leur permettant d’évaluer et de formuler des recommandations fondées sur les applications proposées de l’ingénierie ciblée de la lignée germinale. Enfin, ils signalent l’importance d’établir un mécanisme international qui permettrait la transmission ou la divulgation publique de toute préoccupation ou utilisation de la technologie en dehors des contextes approuvés (lignes directrices et normes établies) aux autorités nationales compétentes.
1CRISPR: Clustered regularly interspaced short palindromic repeats.
Références
Adelman B, Albright C, Andrews L., et al. (2019). Letter to the Secretary of the U.S. Department of Health and Human Services. Web : https://www.asgct.org/global/documents/clinical-germline-gene-editing-letter.pdf.
Baltimore, D., Charo, A., Daley, G. Q., Doudna, J. A., Kato, K., Kim, J-S., et al. (2018). Statement by the Organizing Committee of the Second International Summit on Human Genome Editing. Web : https://www.nationalacademies.org/news/2018/11/statement-by-the-organizing-committee-of-the-second-international-summit-on-human-genome-editing
Baltimore, D., Baylis, F., Berg, P., Daley, G. Q., Doudna, J. A., Lander, E. S., et al. (2015). On Human Gene Editing: International Summit Statement. Web : https://www.nationalacademies.org/news/2015/12/on-human-gene-editing-international-summit-statement.
Barrangou, R. (2018). CRISPR Crossroads for Genome Editing. The CRISPR Journal, 1(6), 349–350.
Baylis, F., Darnovsky, M., Hasson, K., & Krahn, T. M. (2020). Human Germline and Heritable Genome Editing: The Global Policy Landscape. The CRISPR Journal, 3(5), 365-377.
Brokowski, C., 2018. Do CRISPR Germline Ethics Statements Cut It? The CRISPR Journal, 1(2), p.115-125.
Callaway, E. (2016). Embryo editing gets green light. Nature, 530, 18.
Chaib, F. (2019). WHO launches global registry on human genome editing. WHO News. Web : https://www.who.int/news/item/29-08-2019-who-launches-global-registry-on-human-genome-editing.
Charo, A. (2019) Rogues and regulation of germline editing. The New England Journal of Medicine, 380, 976-980.
Cohen, J. (2019). WHO panel proposes new global registry for all CRISPR human experiments. Science. doi: 10.1126/science.aax3948.
Cohen, J., & Normille, D. (2020). China delivers verdict on gene editing of babies. Science, 367(6474), 130.
Cyranoski, D. (2019). Russian ‘CRISPR-baby’ scientist has started editing genes in human eggs with goal of altering deaf gene. Nature, 574, 465-466.
Gallego, J. (2016). Swedish Scientist Begins Editing Human DNA in Health Embryos. Futurism. Web : https://futurism.com/swedish-scientist-begins-editing-human-dna-in-healthy-embryos.
International Commission on the clinical use of heritable human genome editing. (2020). Heritable Human Genome Editing: Consensus Study Report. Web : https://www.nationalacademies.org/our-work/international-commission-on-the-clinical-use-of-human-germline-genome-editing.
Isasi, R., Kleiderman, E., & Knoppers, B. M. (2016). Editing policy to fit the genome? Science, 351(6271), 337-339.
Johnston, J. (2019). He Jiankui is going to jail. Would the U.S. criminally prosecute a rogue gene-editing researcher? Stat News. Web : https://www.statnews.com/2019/12/31/he-jiankui-jail-prosecute-rogue-gene-editing-researcher/.
Knoppers, B. M., & Kleiderman, E. (2019). Heritable Genome Editing: Who Speaks for “Future” Children? The CRISPR Journal, 2(5), 285-292.
Kofler, N. (2019). Why were scientists silent over gene-edited babies? Nature, 566, 427.
Kolata, G., S.-L. Wee, and P. Belluck. (2018). Chinese Scientist Claims to Use CRISPR to Make First Genetically Edited Babies. The New York Times. Web : https://www.nytimes.com/2018/11/26/health/gene-editing-babies-china.html.
Krimsky, S. (2019). Ten Ways in Which He Jiankui Violated Ethics. Nature Biotechnology, 37, 19-20.
Lander, E. S., Baylis, F., Zhang, F., Charpentier, E., Berg, P., Bourgain, C., et al. (2019) Adopt a moratorium on heritable genome editing. Nature, 567, 165-168.
Liang, P., Xu, Y., Zhang, X., Ding, C., Huang, R., Zhang, Z., et al. (2015). CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell 6, 363–372.
Ma, H., Marti-Gutierrez, N., Park, S. W., Wu, J., Lee, Y., Suzuki, K., et al. (2017). Correction of a pathogenic gene mutation in human embryos. Nature, 548(7668), 413-419.
National Academies of Sciences, Engineering, and Medicine (NASEM). (2019). New International Commission Launched on Clinical Use of Heritable Human Genome Editing. Web : https://www.nationalacademies.org/news/2019/05/new-international-commission-launched-on-clinical-use-of-heritable-human-genome-editing
National Academies of Sciences, Engineering, and Medicine (NASEM). (2017). Human Genome Editing: Science, Ethics, and Governance. Web : https://www.nap.edu/catalog/24623/human-genome-editing-science-ethics-and-governance.
Nuffield Council on Bioethics. (2018). Genome editing and human reproduction: social and ethical issues. London: Nuffield Council on Bioethics. Web : https://www.nuffieldbioethics.org/publications/genome-editing-and-human-reproduction.
Pera, M. F. (2017). Human embryo research and the 14-day rule. Development, 144(11), 1923-1925.
Reardon, S. (2019). World Health Organization panel weighs in on CRISPR-babies debate. Nature, 567, 444-445.
Servick, K. (2017). First U.S.-based group to edit human embryos brings practice closer to clinic. Science. doi: 10.1126/science.aan7197.
Townsend, B. A. (2020). Human genome editing: How to prevent rogue actors. BMC Medical Ethics, 21(1), 1-10.
Education vector créé par freepik – www.freepik.com
