MRM Insights – Biofabrication : une perspective sur l’avenir de la médecine personnalisée

Dr Megan Cooke

Dr Rosenzweig
Chaque mois, dans les MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, Dr Derek Rosenzweig, Professeur adjoint au Département de chirurgie à l’Université McGill, et Dr Megan Cooke, chercheuse postdoctorale dans son laboratoire, discutent de la biofabrication comme une perspective sur l’avenir de la médecine personnalisée.
Biofabrication : une perspective sur l’avenir de la médecine personnalisée
La mise sur le marché d’un nouveau traitement est une tâche ardue, dont le coût a été estimé à environ 2 milliards de dollars et qui peut prendre plus de 10 ans (DiMasi et coll., J. Health Econ. 2016, 47:p20-33). Une étude de 2013 a révélé qu’environ 75% des médicaments nouvellement développés n’ont pas réussi les essais cliniques de phase II (Ringel et al., Nature Rev Drug Discov, 12: p901-902), tandis que plusieurs médias signalent des taux d’échec allant jusqu’à 90%. La mauvaise traduction clinique a été principalement attribuée au manque d’efficacité qui est généralement déterminée à l’aide de lignées cellulaires in vitro cultivées sur des boîtes de plastique rigide 2D ou dans des modèles de petits/grands animaux qui ne reproduisent pas avec précision la physiologie, la pathologie ou l’immunité humaines. De nouvelles plateformes de dépistage préclinique qui imitent mieux le microenvironnement physiologique complexe des tumeurs sont nécessaires pour améliorer l’approbation réglementaire et l’application clinique. Ceci est particulièrement important pour le développement de nouveaux traitements pour les maladies dégénératives douloureuses et divers types de patients atteints de cancer. À titre d’excellent exemple, le cancer est la principale cause de décès au Canada, représentant 30 % de tous les décès (https://www.cancer.ca/en/). La Société canadienne du cancer a estimé à plus de 220 000 le nombre de nouveaux cas de cancer et à plus de 82 000 décès attribuables au cancer pour l’année 2019.
La biofabrication peut être décrite comme la fabrication de constructions complexes, ressemblant à des tissus, générées à partir d’une combinaison de cellules vivantes, de biomatériaux et d’autres molécules, produites à l’aide de technologies automatisées telles que la bioimpression. La biofabrication est un développement relativement nouveau dans le domaine du génie tissulaire et est le plus souvent associée à la bioimpression par extrusion 3D – la construction couche par couche de structures tridimensionnelles à l’aide de matériaux ensemencés par des cellules appelées bio-encres. Un avantage majeur de l’utilisation de la bioimpression 3D dans la biofabrication et le génie tissulaire est qu’il existe un niveau élevé de contrôle sur la distribution spatiale de plusieurs types de cellules, matériaux et autres facteurs de manière reproductible. Cette approche peut être utilisée pour incorporer des micro-canaux dans toute la construction, qui peuvent être vascularisés pour permettre l’écoulement des fluides, l’absorption des nutriments et l’élimination des déchets. De nombreux laboratoires ont démontré que ces tissus fournissent des tissus humains fonctionnels et cliniquement pertinents qui peuvent représenter des cancers du cerveau, du sein, de la prostate, des os et du poumon, pour n’en nommer que quelques-uns. Bien que certains chercheurs aient les yeux rivés sur l’utilisation de cette technologie à l’avenir pour reproduire ou remplacer des organes à l’aide des propres cellules souches d’un patient, une application beaucoup plus pratique et immédiate est déjà utilisée à la fois par le milieu universitaire et l’industrie. Le criblage d’une bibliothèque de composés thérapeutiques à haut et moyen débit est facilement appliqué aux modèles de tissus humains bioimprimés en 3D dans des formats de plaques à 96 et 384 puits. Ces plateformes de dépistage utilisent souvent des lignées cellulaires humaines immortalisées, mais plus récemment, des preuves ont émergé en utilisant des cellules dérivées de patients. De telles concepts impliquent la distribution spatiale des cellules tumorales, des cellules stromales et des cellules endothéliales vasculaires. Dans de nombreux cas, ces cellules peuvent être obtenues à partir de donneurs compatibles présentant ainsi un microenvironnement tumoral physiologique de ce patient particulier. Cela ouvre immédiatement la porte à une médecine personnalisée et de précision.
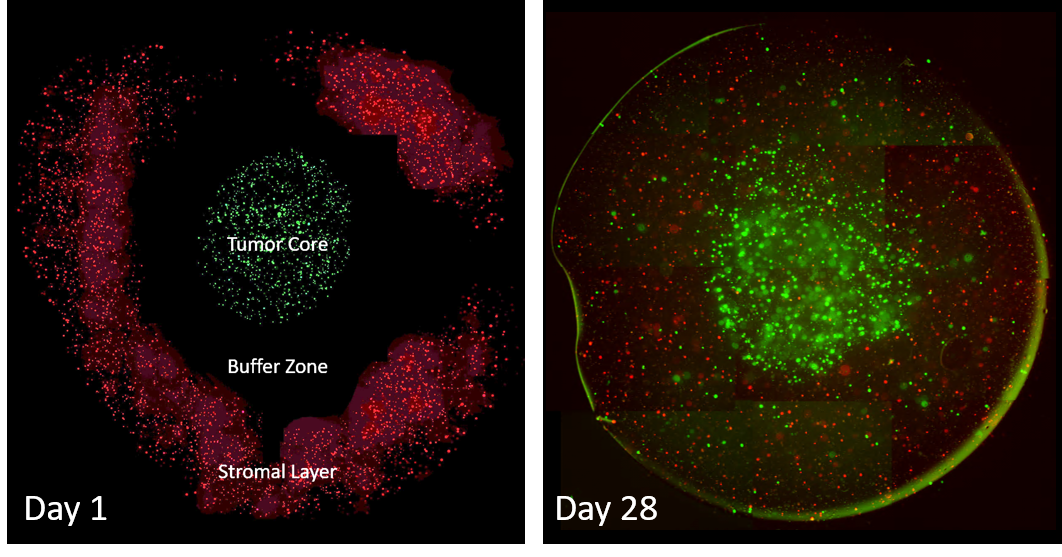
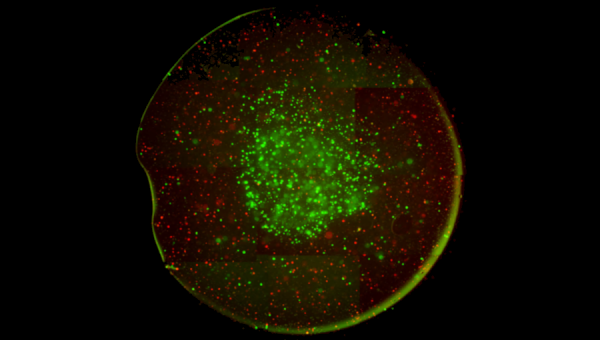
Modèle de microenvironnement tumoral. En utilisant la bio-impression 3D par extrusion, nous générons un « noyau tumoral » avec des cellules de cancer du sein triple négatif étiquetées GFP entourées d’une « zone tampon » de gel vide, qui est également entourée d’une « zone stromale » contenant des ostéoblastes humains primaires (rouges) marqués Vybrant DiI et de nano-hydroxyapatite. Au jour 1, juste après l’impression, le modèle a une forme d’anneau. Durant 28 jours, les cellules tumorales se développent en sphéroïdes mutli-cellulaires et commencent à migrer vers les couches stromales. Dans le même temps, les cellules stromales migrent vers le noyau tumoral. Ce format de métastases sur puce est hautement reproductible, peut être fabriqué en format de plaque de 96 puits et peut inclure n’importe quel nombre de cellules/matériaux. Nous travaillons actuellement sur l’essai de divers traitements pour bloquer cette croissance et cette migration cellulaires et nous travaillerons à développer son utilisation avec des cellules de métastases de la colonne vertébrale dérivées du patient et des ostéoblastes/cellules stromales compatibles avec le patient dans le but d’identifier des thérapies personnalisées.
En plus d’être un outil précieux pour le dépistage thérapeutique, la biofabrication et la bio-impression 3D sont également prometteuses pour l’étude des mécanismes de développement tissulaire et de pathologie tissulaire. Par exemple, plusieurs laboratoires à travers le monde ont utilisé cette approche pour la réparation et la régénération du cartilage et des os ainsi que pour les patchs musculaires cardiaques, pour n’en nommer que quelques-uns. Au cœur de cette approche se trouve l’utilisation de cellules souches mésenchymateuses et de cellules souches pluripotentes induites, souvent dérivées de donneurs patients. En concevant de manière appropriée les géométries des constructions et de la distribution cellulaire, en utilisant la combinaison appropriée de cellules souches et de cellules issues de cultures primaires ainsi que la bio-encre la plus appropriée, des tissus fonctionnels peuvent être générés pour répondre à diverses questions mécanistes. Ces constructions peuvent également être redirigées dans des tests de dépistage thérapeutique. Avec la puissance et l’accessibilité croissantes de la biofabrication, l’avenir de la médecine personnalisée et centrée sur le patient s’annonce chaque jour plus prometteur.
À propos des auteurs :
Dr Derek Rosenzweig est chercheur principal au Département de chirurgie de l’Université McGill et scientifique au Programme de recherche : blessure, réparation, récupération de l’IR-CUSM. Son équipe a développé un modèle de microenvironnement de métastases osseuses en imprimant le noyau de cellules tumorales dérivées du patient dans un hydrogel mou entouré d’ostéoblastes humains normaux, de cellules stromales et de cellules endothéliales dans un hydrogel plus rigide contenant de la nano-hydroxyapatite. Des microcanaux sont également incorporés pour l’écoulement du fluide. De nouveaux dispositifs thérapeutiques d’administration sont examinés en comparaison avec la chimiothérapie standard pour bloquer la prolifération cellulaire tumorale et la migration vers un environnement semblable à celui des os. La Dre Cooke a joué un rôle essentiel dans l’élaboration de ce système.
Dr Megan Cooke est boursière postdoctorale des IRSC et du FRQNT. Elle a précédemment travaillé sur le développement d’une nouvelle méthode de bio-impression pour surmonter les limites de l’impression de bio-encres de très faible viscosité, proche de celle de l’eau. Cela repose sur l’utilisation d’un bain de support rempli de microgel, dans lequel les bio-encres ensemencées par des cellules sont imprimées avant la solidification. Elle développe actuellement des bains de microgel pour soutenir la formation de structures vasculaires entre les particules de gel. En utilisant des méthodes de bio-impression, nous pouvons déposer des matériaux, des cellules et des sphéroïdes cellulaires avec un grand contrôle sur leur distribution spatiale en 3D. Ce modèle sera utilisé pour étudier les réponses tumorales pro-angiogéniques ainsi que les anomalies vasculaires dans la guérison des fractures osseuses.
Illustrations:
Crédit photo : avec la permission des Drs Pouyan Ahangar et Megan Cooke
