MRM Insights : Étudier les cellules souches musculaires dans le contexte de leur environnement de niche pendant le développement et les maladies

Darren Blackburn

Dr Vahab Soleimani
Chaque mois, dans MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, Dr Vahab Soleimani, Professeur agrégé au Département de génétique humaine à l’université McGill et chercheur à l’Institut Lady Davis, et Darren Blackburn, candidat au doctorat dans son laboratoire, discutent de l’étude des cellules souches musculaires dans le contexte de leur environnement de niche.
Étudier les cellules souches musculaires dans le contexte de leur environnement de niche pendant le développement et les maladies
Le muscle squelettique est le plus grand tissu du corps humain et a évolué pour la génération de force1. Dans ce tissu réside une population de cellules souches adultes rares connues sous le nom de cellules satellites ou cellules souches musculaires (muscle stem cells, MuSCs). Ces cellules sont absolument nécessaires à la régénération et au maintien tout au long de la vie du muscle squelettique2,3. Dans des conditions normales, les MuSCs resteront dans un état de repos4. Cependant, lorsque le muscle est blessé, elles répondront rapidement en s’activant, proliférant transitoirement et en se différenciant, tandis que certaines reviendront à la quiescence pour reconstituer le pool de cellules souches. Lorsque le signal d’activation arrive, les MuSCs initieront le programme myogénique par l’expression temporelle étroitement régulée des quatre facteurs myogènes : Myf5, MyoD, Myogenin et Myf65. Myf5 et MyoD sont les premiers des facteurs à être exprimés, favorisant la prolifération des MuSCs et les transformant en myoblastes cycliques6,7. Par la suite, MyoD et Myogenin seront exprimés conjointement, poussant les myoblastes vers la différenciation terminale en tant que myocytes, tout en permettant la fusion de ces cellules pour former des myotubes, ou pour fusionner avec des fibres musculaires préexistantes8. Dans les fibres musculaires matures, Myf6 sera le dernier facteur myogénique exprimé9.
On sait que les cellules souches adultes existent dans un environnement de niche qui maintient leur population et régulera leur fonction10. Le concept d’un environnement de niche pour les cellules souches adultes a été mentionné pour la première fois en 197811. Une niche est plus qu’un emplacement physique, mais aussi un point de liaison où les signaux extrinsèques peuvent se rassembler et interagir avec les cellules souches et si la cellule souche est retirée de cette niche, le résultat est la différenciation ou la mort cellulaire. Les MuSCs ne font pas exception et existent dans une niche physique clairement définie, résidant entre la lame basale et le sarcolemme des fibres musculaires12. En fait, c’est cet emplacement unique qui a d’abord permis de supposer que les MuSCs étaient des cellules souches adultes. Elles seraient les seules cellules souches adultes à avoir été initialement identifiées en raison de leur emplacement anatomique, et pas de leur fonction biologique.
La niche des MuSCs est complexe et composée d’un grand nombre de types de cellules différents12. En outre, la niche est un environnement dynamique et change au cours des maladies et pendant le vieillissement normal. Une composante majeure de la niche des MuSCs est la fibre musculaire elle-même. En plus d’être la cellule sur laquelle la MuSC est posée, la fibre musculaire joue également un rôle de signalisation, produisant un certain nombre de facteurs de croissance et de myokines qui interagissent directement avec les MuSCs. Un exemple de ceci est le facteur de croissance EGF, qui est produit par la fibre musculaire et qui est sous le contrôle transcriptionnel de Myf69. L’EGF affecte les MuSCs, entre autres, en favorisant la division asymétrique, ce qui permet de maintenir le pool de MuSCs13. De plus, la fibre musculaire produit également des ligands impliqués dans des voies cruciales, y compris les ligands Notch et WNT14.
D’autres composants cruciaux de la niche comprennent les cellules non myogènes telles que les progéniteurs fibro/adipogènes (Fibro/Adipogenic Progenitors, FAPs), les macrophages, les cellules endothéliales et les fibroblastes, entre autres. On sait que les FAPs produisent de nombreux composants de la matrice extracellulaire (MEC) et que la rigidité de la MEC est l’un des facteurs qui influencent le comportement des MuSCs. En outre, les FAPs soutiennent les MuSCs pendant la régénération musculaire, sécrétant un certain nombre de facteurs qui affecteront directement les MuSCs, par exemple WISP-1 qui favorise la prolifération des MuSCs en activant la voie AKT, ou pour influencer d’autres types de cellules, tels que la sécrétion d’IL-33 qui aide au recrutement des lymphocytes T, nécessaires à la régénération musculaire appropriée15,16. Les macrophages, au-delà de leur rôle bien établi dans l’élimination des débris et la décomposition des tissus endommagés, communiquent également directement avec les MuSCs. Les macrophages sont classiquement divisés en deux sous-groupes : M1, qui sont considérés comme pro-inflammatoires, et M2 qui sont anti-inflammatoires17. Au cours de la régénération, les macrophages sont principalement de type M1, et ces cellules sécrètent des cytokines qui favorisent la prolifération des MuSCs, comme l’IGF-118. Quand la transition vers les macrophages de type M2 a lieu, les cytokines sécrétées passent également de celles promouvant la prolifération à celles encourageant la différenciation des MuSCs, comme GDF319. Au-delà de leur effet sur les MuSCs, les macrophages et les FAPs interagissent également les uns avec les autres pour maintenir la niche des MuSCs. Au cours des premiers stades de la régénération, les macrophages M1 induisent l’apoptose dans les FAPs en sécrétant du TNF, cette action empêche l’accumulation de FAPs et la fibrose20. Cependant, au cours des dernières étapes de la régénération, les macrophages M2 produisent du TGF-Bêta, qui stoppe l’élimination des FAPs et permet au tissu de revenir à un état d’homéostasie20.
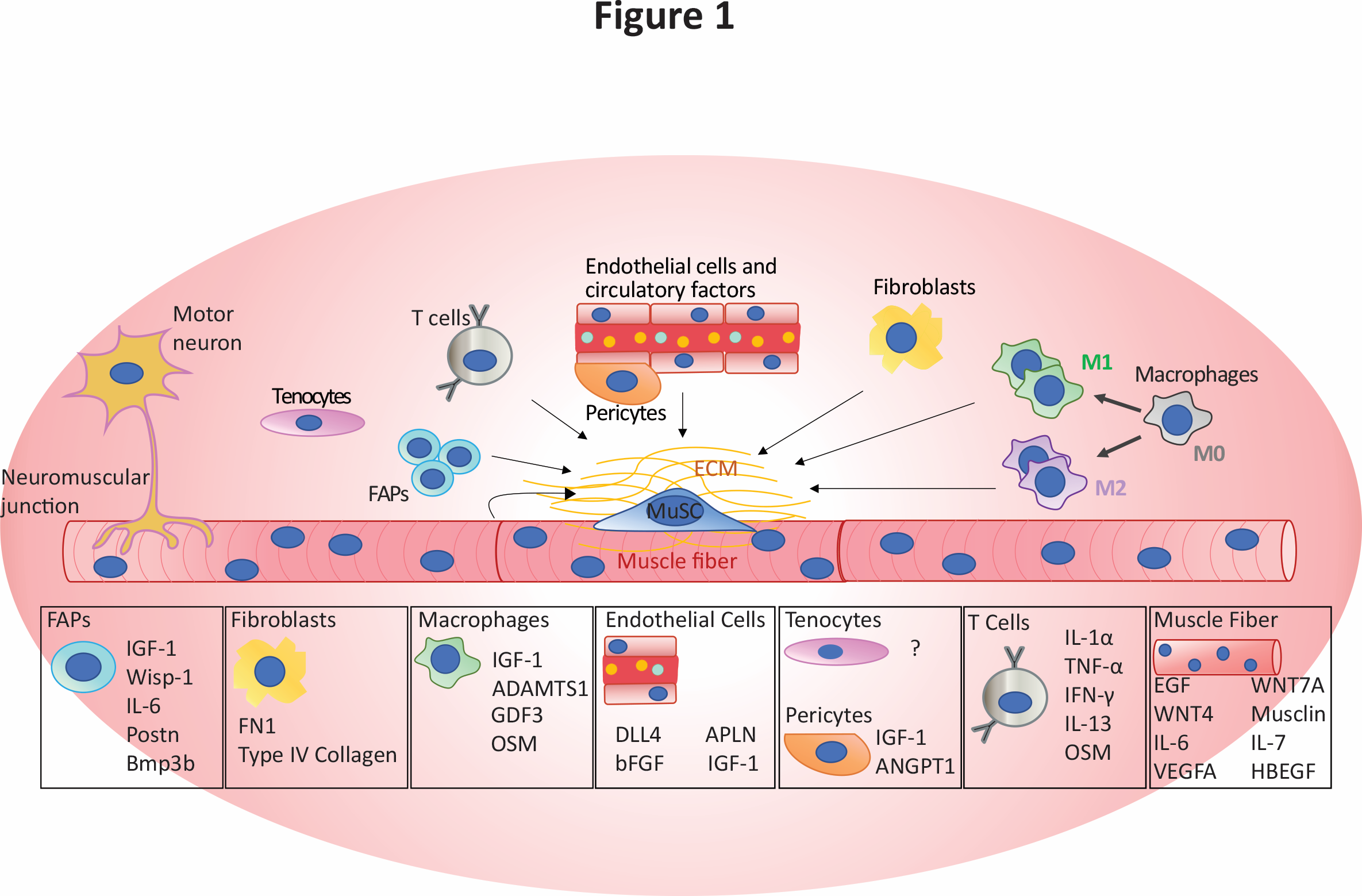
Figure 1: Composants de la niche des MuSCs et facteurs sécrétés connus pour influencer les MuSCs et d’autres éléments de niche, issu de Blackburn et al. 2021, Critical Reviews in Biochemistry and Molecular Biology 202121.
Bien que les MuSCs aient une capacité remarquable à régénérer les tissus endommagés, le vieillissement a un effet néfaste sur elles et leur environnement de niche22. Alors qu’il y a beaucoup de changements intrinsèques à la cellule liés à l’âge dans les MuSCs qui contribuent à la perte de leur potentiel régénérateur, il y a aussi des facteurs contributifs importants découlant de la niche des MuSCs qui ont un effet sur les cellules souches au cours de la maladie et du vieillissement. Il est bien établi que lorsque les humains vieillissent, le muscle squelettique présente une augmentation de fibrose et de l’infiltration de graisse23,24. Au-delà ça, les membres de la niche subiront des changements dans le nombre, la fonction et le sous-type, qui peuvent tous avoir des effets négatifs sur la fonction des MuSCs. Par exemple, les fibres musculaires chez les souris âgées produisent des niveaux plus élevés de FGF2, ce qui réduit la capacité des MuSCs à rester quiescentes et pourrait entraîner une réduction du pool de cellules souches25.
Étant donné que laniche joue un rôle essentiel dans la régulation de la fonction des MuSCs, il est crucial de les étudier dans le contexte de leur environnement de niche. Le retrait des MuSCs de leur environnement de niche et leur expansion ex vivo entraînent une réduction significative de leur propriété de cellules souches, fournissant ainsi aux chercheurs des données qui peuvent ne pas refléter leur comportement normal. Alors que la référence absolue pour la recherche serait de mener des études in vivo, l’un des grands défis à relever avec les MuSCs est leur rareté, et les méthodes de séquençage traditionnelles n’étaient pas capables de capturer pleinement leur transcriptome et leur épigénome. En plus de la rareté des MuSCs elles-mêmes, la niche du muscle squelettique est également très complexe et hétérogène. Le RNA-Seq de masse, contrairement au RNA-Seq en cellule unique, sera en mesure de capturer l’expression moyenne à travers les tissus, mais sera incapable d’attribuer des gènes à des types de cellules spécifiques, ce qui rendra difficile la conception d’expériences pour capturer le transcriptome et l’épigénome spécifiques aux cellules.
Les progrès récents dans les technologies de séquençage de nouvelle génération, y compris le séquençage unicellulaire, permettent maintenant d’analyser et de caractériser des types de cellules rares à la fois au niveau du tissu et au niveau d’une cellule unique. Ces progrès ont été rendus possibles par le développement de la technique SMART-Seq (Switching Mechanism at 5′ end of RNA Template) et des technologies comme la tagmentation basée sur la transposase Tn5 qui permettent de contourner la limitation du faible nombre de cellules26.
On s’attend à ce que l’application de ces outils puissants permette aux chercheurs d’améliorer considérablement la compréhension du comportement des cellules souches adultes dans le contexte de niche et de la façon dont cette interaction est modifiée au cours du vieillissement et de la maladie. Ces dernières années, ces technologies ont déjà été appliquées pour évaluer comment l’environnement de niche et les MuSCs interagissent lors de blessures aiguës, et comment la niche peut affecter la fonction des MuSCs dans le vieillissement. Récemment, un article a utilisé le RNA-Seq unicellulaire pour caractériser la niche musculaire pendant les étapes de la blessure aiguë, révélant une niche incroyablement dynamique qui change rapidement en réponse à une blessure et revient également rapidement à l’homéostasie après régénération27. De plus, une autre étude utilisant le RNA-Seq unicellulaire chez des souris jeunes et âgées a révélé que dans le muscle âgé, il y a une augmentation du nombre de FAPs, ce qui peut contribuer à une augmentation du dépôt de la MEC et de sa rigidité, une augmentation de la rigidité pouvant avoir un impact négatif sur la fonction des MuSCs28,29. Au cours du vieillissement, il y a aussi un changement dans le sous-type de macrophages, provocant un passage des macrophages anti-inflammatoires vers les macrophages pro-inflammatoires28. L’avènement de la technologie SMART permet également le séquençage d’échantillons infimes, ce qui était auparavant irréalisable, comme l’analyse du transcriptome entier d’une seule fibre musculaire14,26.
Bien que le séquençage de l’ARN en cellule unique soit un outil puissant pour déterminer l’hétérogénéité des populations cellulaires au sein d’un tissu, il ne capture cependant pas à lui seul la distribution spatiale de cellules spécifiques ou la communication potentielle de cellule à cellule30. Les progrès récents en transcriptomique spatiale tels que l’imagerie ARN High-plex ou le codage à barres spatial peuvent être utilisés pour localiser des cellules spécifiques dans un emplacement anatomique défini dans un tissu30. La combinaison de ces derniers outils avec des technologies unicellulaires et des méthodes computationnelles à haut débit devrait fournir des informations détaillées sur la façon dont les cellules souches adultes communiquent avec leur environnement de niche pendant le développement et les maladies. Ces nouvelles connaissances serviront de base au développement de nouvelles thérapies pour le traitement des maladies provoquant la fonte musculaire telles que la sarcopénie liée à l’âge et les troubles neuromusculaires.
Références
1 Janssen, I., Heymsfield, S. B., Wang, Z. M. & Ross, R. Skeletal muscle mass and distribution in 468 men and women aged 18-88 yr. J Appl Physiol (1985) 89, 81-88, doi:10.1152/jappl.2000.89.1.81 (2000).
2 Le Grand, F. et al. Six1 regulates stem cell repair potential and self-renewal during skeletal muscle regeneration. J Cell Biol 198, 815-832, doi:10.1083/jcb.201201050 (2012).
3 Wang, Y. X. & Rudnicki, M. A. Satellite cells, the engines of muscle repair. Nat Rev Mol Cell Biol 13, 127-133, doi:10.1038/nrm3265 (2011).
4 Schultz, E., Gibson, M. C. & Champion, T. Satellite cells are mitotically quiescent in mature mouse muscle: an EM and radioautographic study. J Exp Zool 206, 451-456, doi:10.1002/jez.1402060314 (1978).
5 Braun, T., Bober, E., Winter, B., Rosenthal, N. & Arnold, H. H. Myf-6, a new member of the human gene family of myogenic determination factors: evidence for a gene cluster on chromosome 12. EMBO J 9, 821-831 (1990).
6 Davis, R. L., Weintraub, H. & Lassar, A. B. Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell 51, 987-1000, doi:10.1016/0092-8674(87)90585-x (1987).
7 Weintraub, H. et al. Activation of muscle-specific genes in pigment, nerve, fat, liver, and fibroblast cell lines by forced expression of MyoD. Proc Natl Acad Sci U S A 86, 5434-5438, doi:10.1073/pnas.86.14.5434 (1989).
8 Hasty, P. et al. Muscle deficiency and neonatal death in mice with a targeted mutation in the myogenin gene. Nature 364, 501-506, doi:10.1038/364501a0 (1993).
9 Lazure, F. et al. Myf6/MRF4 is a myogenic niche regulator required for the maintenance of the muscle stem cell pool. EMBO Rep, e49499, doi:10.15252/embr.201949499 (2020).
10 Crane, G. M., Jeffery, E. & Morrison, S. J. Adult haematopoietic stem cell niches. Nat Rev Immunol 17, 573-590, doi:10.1038/nri.2017.53 (2017).
11 Schofield, R. The relationship between the spleen colony-forming cell and the haemopoietic stem cell. Blood Cells 4, 7-25 (1978).
12 Yin, H., Price, F. & Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiol Rev 93, 23-67, doi:10.1152/physrev.00043.2011 (2013).
13 Wang, Y. X. et al. EGFR-Aurka Signaling Rescues Polarity and Regeneration Defects in Dystrophin-Deficient Muscle Stem Cells by Increasing Asymmetric Divisions. Cell Stem Cell 24, 419-432 e416, doi:10.1016/j.stem.2019.01.002 (2019).
14 Blackburn, D. M. et al. High-resolution genome-wide expression analysis of single myofibers using SMART-Seq. J Biol Chem 294, 20097-20108, doi:10.1074/jbc.RA119.011506 (2019).
15 Kuswanto, W. et al. Poor Repair of Skeletal Muscle in Aging Mice Reflects a Defect in Local, Interleukin-33-Dependent Accumulation of Regulatory T Cells. Immunity 44, 355-367, doi:10.1016/j.immuni.2016.01.009 (2016).
16 Lukjanenko, L. et al. Aging Disrupts Muscle Stem Cell Function by Impairing Matricellular WISP1 Secretion from Fibro-Adipogenic Progenitors. Cell Stem Cell 24, 433-446 e437, doi:10.1016/j.stem.2018.12.014 (2019).
17 Martinez, F. O. & Gordon, S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000Prime Rep 6, 13, doi:10.12703/P6-13 (2014).
18 Tidball, J. G. & Welc, S. S. Macrophage-Derived IGF-1 Is a Potent Coordinator of Myogenesis and Inflammation in Regenerating Muscle. Mol Ther 23, 1134-1135, doi:10.1038/mt.2015.97 (2015).
19 Varga, T. et al. Macrophage PPARgamma, a Lipid Activated Transcription Factor Controls the Growth Factor GDF3 and Skeletal Muscle Regeneration. Immunity 45, 1038-1051, doi:10.1016/j.immuni.2016.10.016 (2016).
20 Lemos, D. R. et al. Nilotinib reduces muscle fibrosis in chronic muscle injury by promoting TNF-mediated apoptosis of fibro/adipogenic progenitors. Nat Med 21, 786-794, doi:10.1038/nm.3869 (2015).
21 Blackburn, D. M., Lazure, F. & Soleimani, V. D. SMART approaches for genome-wide analyses of skeletal muscle stem and niche cells. Crit Rev Biochem Mol Biol 56, 284-300, doi:10.1080/10409238.2021.1908950 (2021).
22 Shefer, G., Rauner, G., Yablonka-Reuveni, Z. & Benayahu, D. Reduced satellite cell numbers and myogenic capacity in aging can be alleviated by endurance exercise. PLoS One 5, e13307, doi:10.1371/journal.pone.0013307 (2010).
23 Wang, Y., Wehling-Henricks, M., Samengo, G. & Tidball, J. G. Increases of M2a macrophages and fibrosis in aging muscle are influenced by bone marrow aging and negatively regulated by muscle-derived nitric oxide. Aging Cell 14, 678-688, doi:10.1111/acel.12350 (2015).
24 Hamrick, M. W., McGee-Lawrence, M. E. & Frechette, D. M. Fatty Infiltration of Skeletal Muscle: Mechanisms and Comparisons with Bone Marrow Adiposity. Front Endocrinol (Lausanne) 7, 69, doi:10.3389/fendo.2016.00069 (2016).
25 Chakkalakal, J. V., Jones, K. M., Basson, M. A. & Brack, A. S. The aged niche disrupts muscle stem cell quiescence. Nature 490, 355-360, doi:10.1038/nature11438 (2012).
26 Picelli, S. et al. Full-length RNA-seq from single cells using Smart-seq2. Nat Protoc 9, 171-181, doi:10.1038/nprot.2014.006 (2014).
27 De Micheli, A. J., Spector, J. A., Elemento, O. & Cosgrove, B. D. A reference single-cell transcriptomic atlas of human skeletal muscle tissue reveals bifurcated muscle stem cell populations. Skelet Muscle 10, 19, doi:10.1186/s13395-020-00236-3 (2020).
28 Lazure, F. et al. Transcriptional Reprogramming of Skeletal Muscle Stem Cells by the Niche Environment. bioRxiv, 2021.2005.2025.445621, doi:10.1101/2021.05.25.445621 (2021).
29 Lacraz, G. et al. Increased Stiffness in Aged Skeletal Muscle Impairs Muscle Progenitor Cell Proliferative Activity. PLoS One 10, e0136217, doi:10.1371/journal.pone.0136217 (2015).
30 Longo, S. K., Guo, M. G., Ji, A. L. & Khavari, P. A. Integrating single-cell and spatial transcriptomics to elucidate intercellular tissue dynamics. Nat Rev Genet, doi:10.1038/s41576-021-00370-8 (2021).
31 Garg, K. & Boppart, M. D. Influence of exercise and aging on extracellular matrix composition in the skeletal muscle stem cell niche. J Appl Physiol (1985) 121, 1053-1058, doi:10.1152/japplphysiol.00594.2016 (2016).
32 Distefano, G. & Goodpaster, B. H. Effects of Exercise and Aging on Skeletal Muscle. Cold Spring Harb Perspect Med 8, doi:10.1101/cshperspect.a029785 (2018).
Crédit photo : Image of an isolated EDL myofiber and its associated muscle stem cells after 48 hours in culture, avec la permission de Darren Blackburn.
