MRM Insights : MYSM1 dans la régulation épigénétique de l’hématopoïèse des mammifères

Jooeun (June) Kim

HanChen Wang

Dre Anastasia Nijnik
Chaque mois, dans MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, la Dre Anastasia Nijnik, Professeure agrégée au Département de physiologie à l’Université McGill, et les membres de son laboratoire, HanChen Wang (Assistant de recherche) et June Kim (candidate à la maîtrise), discutent du rôle de MYSM1 dans la régulation épigénétique de l’hématopoïèse des mammifères.
MYSM1 dans la régulation épigénétique de l’hématopoïèse des mammifères : des modèles murins aux patients
Le sang et le système immunitaire ont parmi les plus hauts taux de renouvellement cellulaire dans le corps humain, avec des centaines de milliards de nouvelles cellules produites quotidiennement. Le processus de production de sang et de cellules immunitaires est connu sous le nom d’hématopoïèse et est maintenu par les cellules souches hématopoïétiques et progénitrices (hematopoietic stem and progenitor cells, HSPC) dans notre moelle osseuse. La différenciation des HSPC en différentes lignées de cellules sanguines et immunitaires nécessite des changements précis dans l’expression des gènes et est contrôlée par de nombreux facteurs de transcription, des enzymes modifiant la chromatine et d’autres régulateurs épigénétiques. La dérégulation des mécanismes épigénétiques contrôlant la production de sang et de cellules immunitaires peut causer des maladies humaines majeures, notamment des leucémies, des anémies, des immunodéficiences et des défaillances de la moelle osseuse, mais notre compréhension de ces mécanismes reste incomplète.
L’International Knockout Mouse Consortium (IKMC) a été créé peu de temps après la publication des premiers assemblages de génomes humains et murins, dans le but de caractériser les fonctions de tous les gènes codant pour les protéines de mammifères1, 2. Poursuivant ses travaux en tant que Consortium international de phénotypage de souris (International Mouse Phenotyping Consortium, IMPC), il s’agit d’une ressource vitale pour la science biomédicale, regroupant des registres majeurs de lignées de souris knockout, de cellules souches embryonnaires de souris (mouse embryonic stem cells, ESCs) et de données phénotypiques qui décrivent les effets de la perte de fonction de plus de 7 500 gènes sur la physiologie des mammifères.
J’ai rencontré pour la première fois la protéine Myb-like SWIRM and MPN domains 1 (MYSM1)3 en tant que stagiaire postdoctorale invitée travaillant avec l’IKMC / IMPC au Wellcome Trust Sanger Institute à Cambridge (Royaume-Uni), il y a maintenant plus de 10 ans. À cette époque, MYSM1 était connu comme une protéine nucléaire avec une activité catalytique déubiquitinase qui élimine la marque épigénétique inhibitrice histone H2A-K119ub de la chromatine4, 5. Cependant, les rôles de MYSM1 in vivo dans la régulation du développement et de la physiologie des mammifères étaient inconnus.
Au cours des 10 dernières années au Département de physiologie de l’Université McGill, mon équipe de recherche a caractérisé MYSM1 comme un régulateur majeur de la fonction des HSPC et de l’hématopoïèse des mammifères3, en s’appuyant sur les ressources de l’IKMC/IMPC tout au long de nos travaux. Nos contributions comprennent la caractérisation des fonctions de MYSM1 à travers différentes lignées de cellules sanguines et immunitaires à l’aide de modèles murins knock-out conditionnels, et la démonstration que la perte de cellules sanguines dans le déficit en MYSM1 est médiée par p53 et ses voies de réponse au stress en aval3, 6-10. Fait important, au cours des dernières années, des mutations de MYSM1 ont également été observées chez de rares patients humains atteints d’anémie, d’immunodéficience et d’insuffisance médullaire3, indiquant la conservation de la fonction MYSM1 entre l’homme et la souris et nous encourageant à élargir notre travail avec des collaborations cliniques.
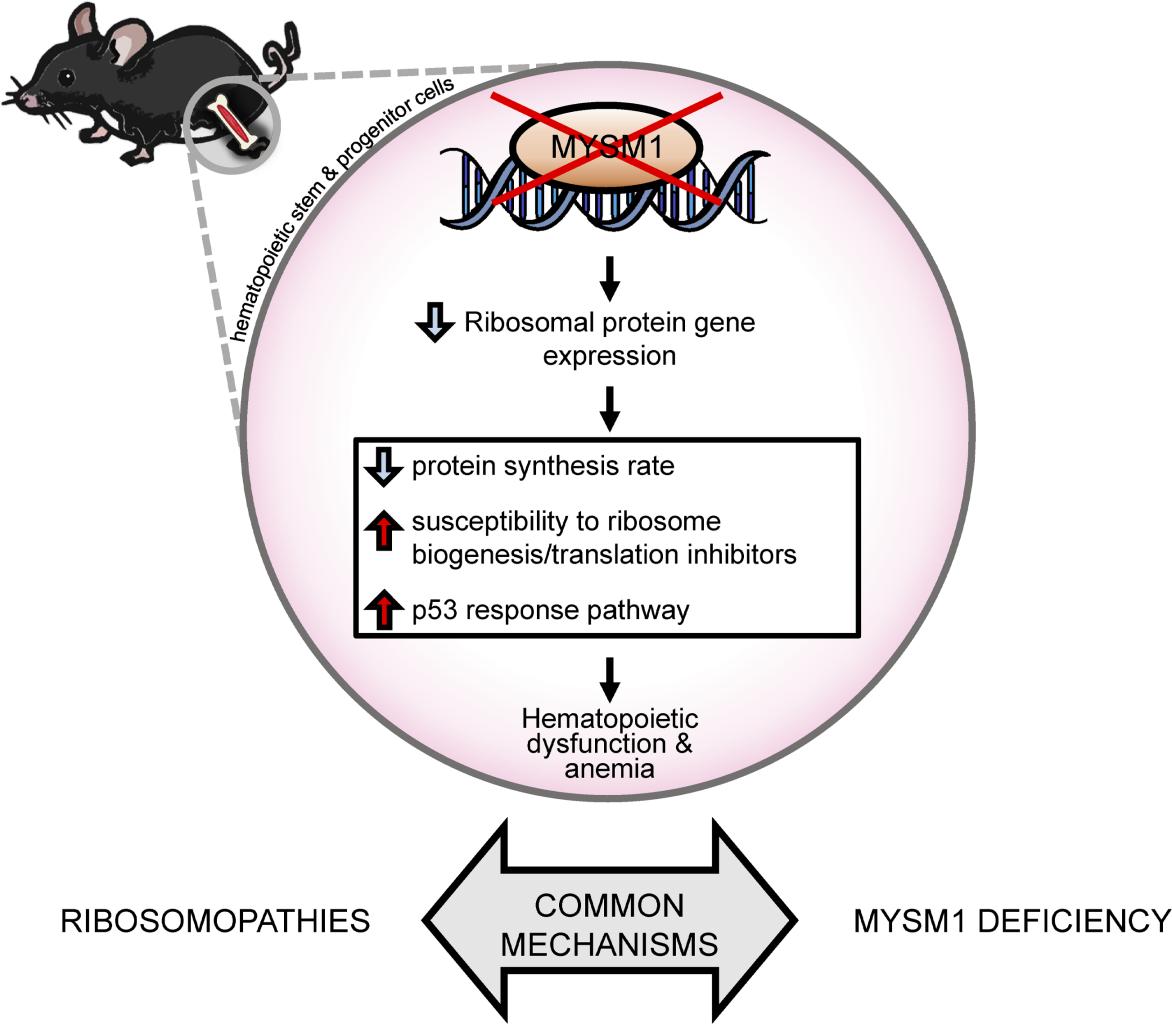
Figure 1. Mécanismes du dysfonctionnement hématopoïétique dans le déficit en MYSM1; (publié dans JCI Insight. 2020;5(13):e125690).
Puisque MYSM1 est un régulateur épigénétique, la caractérisation des gènes directement régulés par MYSM1 chez les HSPC de mammifères a été un objectif majeur à long terme pour mon équipe de recherche. Ces travaux ont été menés en collaboration avec le Dr David Langlais (Centre de génomique de McGill) et ont fourni des informations inattendues sur les mécanismes moléculaires reliant la perte de MYSM1 à l’insuffisance médullaire11. L’étude a révélé que MYSM1 maintient l’expression des gènes codant pour les protéines du ribosome dans les HSPC de souris, la perte de MYSM1 entraînant une régulation négative de ces gènes, une réduction des taux de synthèse des protéines cellulaires et l’activation de p53, probablement via les mécanismes de point de contrôle de la biogenèse ribosomique11, 12. Cela nous a conduits à la conclusion inattendue que le déficit en MYSM1 peut être classé comme une forme de ribosomopathie, avec des mécanismes moléculaires similaires conduisant à un dysfonctionnement hématopoïétique comme dans l’anémie de Diamond-Blackfan (DBA)13. En effet, dans des études récentes, il avait été démontré que certains patients diagnostiqués avec la DBA étaient porteurs de mutations de MYSM114, ce qui confirme nos conclusions.
- Figure 2. Croissance des iPSC humaines pour l’étude des fonctions de MYSM1 dans l’hématopoïèse humaine; (image de HanChen Wang, Université McGill).
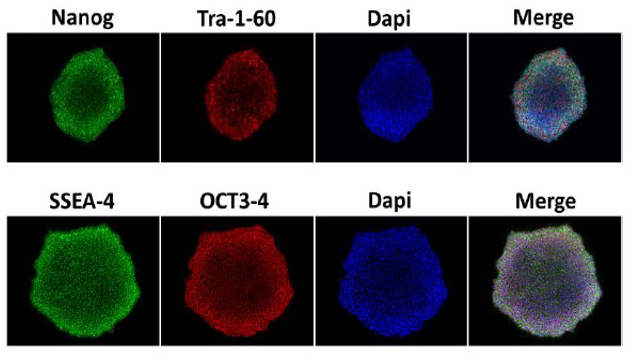
- Figure 3. Coloration des iPSC humaines déficientes en MYSM1 pour les marqueurs de pluripotence; (image reproduite avec l’aimable autorisation de Carole Chen et du Dr Tom Durcan et de la Plateforme de découverte de médicaments en phase précoce de l’Institut-Hôpital neurologique de Montréal).
Un objectif important de nos travaux en cours est de valider les mécanismes moléculaires reliant le déficit en MYSM1 au dysfonctionnement hématopoïétique dans un système humain. Avec le soutien du réseau de médecine régénérative de McGill, et en partenariat avec la Plateforme de découverte de médicaments en phase précoce (PDMPP) de l’Institut neurologique de Montréal et la Plateforme de reprogrammation de cellules Charles-Bruneau du Centre Hospitalier Universitaire Sainte-Justine, nous avons établi un ensemble de cellules souches pluripotentes induites humaines (iPSC) porteuses de mutations perte de fonction MYSM1. Nos travaux en cours avec ces iPSC augurent de faire progresser la compréhension des mécanismes de l’insuffisance médullaire dans la carence en MYSM1 chez l’humain.
An important aim of our ongoing work is to validate the molecular mechanisms linking MYSM1 deficiency to hematopoietic dysfunction in a human system. With the support of the McGill Regenerative Medicine network, and in partnership with the Early Drug Discovery Unit of the Montreal Neurological Institute, and the Charles-Bruneau Plateforme de Reprogrammation de Cellules of the Centre Hospitalier Universitaire Sainte-Justine, we have established a set of human induced pluripotent stem cells (iPSCs), carrying MYSM1 loss of function mutations. Our ongoing work with these iPSCs promises to advance the understanding of the mechanisms of bone marrow failure in MYSM1 deficiency in humans.
Un autre objectif de nos travaux en cours est d’explorer comment MYSM1 fonctionne pour maintenir l’expression des gènes ribosomiques, et nos résultats indiquent une coopération entre MYSM1 et le facteur de transcription oncogène cMYC. Fait important, nous avons également montré que la perte de MYSM1 inhibe l’activité oncogène de cMYC et protège contre l’apparition et la progression du lymphome cMYC dans des modèles murins15. Dans le cadre de travaux futurs, avec le soutien de la Société canadienne de leucémie et lymphome, nous espérons développer ces études afin d’explorer MYSM1 comme cible médicamenteuse possible pour les tumeurs malignes hématologiques induites par cMYC.
Références
1. Skarnes WC, Rosen B, West AP, Koutsourakis M, Bushell W, Iyer V, et al. A conditional knockout resource for the genome-wide study of mouse gene function. Nature 2011, 474(7351): 337-342.
2. Bradley A, Anastassiadis K, Ayadi A, Battey JF, Bell C, Birling MC, et al. The mammalian gene function resource: the International Knockout Mouse Consortium. Mamm Genome 2012, 23(9-10): 580-586.
3. Fiore A, Liang Y, Lin YH, Tung J, Wang H, Langlais D, et al. Deubiquitinase MYSM1 in the Hematopoietic System and beyond: A Current Review. Int J Mol Sci 2020, 21(8).
4. Zhu P, Zhou W, Wang J, Puc J, Ohgi KA, Erdjument-Bromage H, et al. A histone H2A deubiquitinase complex coordinating histone acetylation and H1 dissociation in transcriptional regulation. Mol Cell 2007, 27(4): 609-621.
5. Belle JI, Nijnik A. H2A-DUBbing the mammalian epigenome: expanding frontiers for histone H2A deubiquitinating enzymes in cell biology and physiology. The International Journal of Biochemistry & Cell Biology 2014, 50: 161-174.
6. Nijnik A, Clare S, Hale C, Raisen C, McIntyre RE, Yusa K, et al. The critical role of histone H2A-deubiquitinase Mysm1 in hematopoiesis and lymphocyte differentiation. Blood 2012, 119(6): 1370-1379.
7. Belle JI, Langlais D, Petrov JC, Pardo M, Jones RG, Gros P, et al. p53 mediates loss of hematopoietic stem cell function and lymphopenia in Mysm1 deficiency. Blood 2015, 125(15): 2344-2348.
8. Belle JI, Petrov JC, Langlais D, Robert F, Cencic R, Shen S, et al. Repression of p53-target gene Bbc3/PUMA by MYSM1 is essential for the survival of hematopoietic multipotent progenitors and contributes to stem cell maintenance. Cell Death Differ 2016, 23(5): 759-775.
9. Forster M, Farrington K, Petrov JC, Belle JI, Mindt BC, Witalis M, et al. MYSM1-dependent checkpoints in B cell lineage differentiation and B cell-mediated immune response. J Leukoc Biol 2017, 101(3): 643-654.
10. Forster M, Boora RK, Petrov JC, Fodil N, Albanese I, Kim J, et al. A role for the histone H2A deubiquitinase MYSM1 in maintenance of CD8(+) T cells. Immunology 2017, 151(1): 110-121.
11. Belle JI, Wang H, Fiore A, Petrov JC, Lin YH, Feng CH, et al. MYSM1 maintains ribosomal protein gene expression in hematopoietic stem cells to prevent hematopoietic dysfunction. JCI Insight 2020, 5(13).
12. Zhang Y, Lu H. Signaling to p53: ribosomal proteins find their way. Cancer Cell 2009, 16(5): 369-377.
13. Ito E, Konno Y, Toki T, Terui K. Molecular pathogenesis in Diamond-Blackfan anemia. Int J Hematol 2010, 92(3): 413-418.
14. Ulirsch JC, Verboon JM, Kazerounian S, Guo MH, Yuan D, Ludwig LS, et al. The Genetic Landscape of Diamond-Blackfan Anemia. Am J Hum Genet 2019, 104(2): 356.
15. Lin YH, Wang H, Fiore A, Forster M, Tung LT, Belle JI, et al. Loss of MYSM1 inhibits the oncogenic activity of cMYC in B cell lymphoma. J Cell Mol Med 2021, 25(14): 7089-7094.
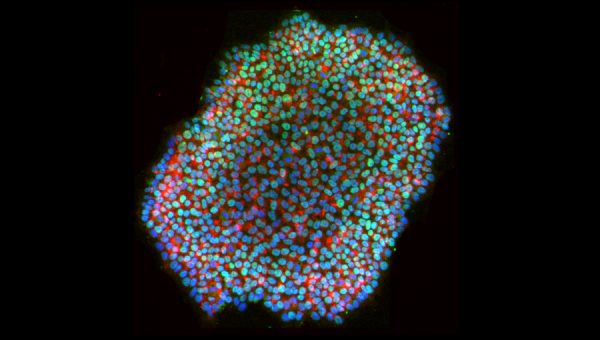
Crédit photo : Image d’une coloration par immunofluorescence des marqueurs de pluripotence Nanog (vert) et Tra1-60 (rouge), avec contre-marquage d’acide nucléique Hoechst 33342 (bleu) sur MYSM1-KO/F0443.3-C3 IPSC, avec l’aimable autorisation de Carol Chen.