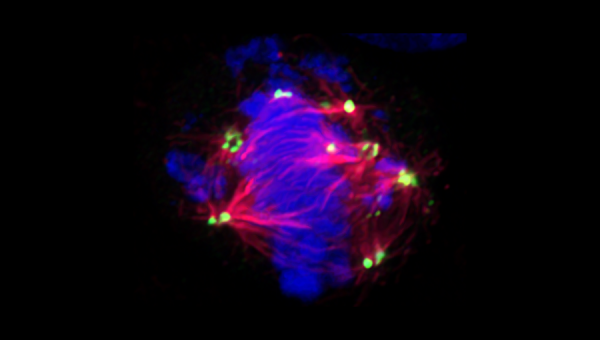
MRM Insights : Division cellulaire asymétrique et caractère souche des cellules cancéreuses

Henry Yu

Dr Moulay Alaoui-Jamali
Chaque mois, dans MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, le Dr Moulay Alaoui-Jamali, Professeur et chercheur principal au Département de médecine et d’oncologie à l’Université McGill et son étudiant au doctorat Henry Yu nous parlent du rôle de la division cellulaire asymétrique et de l’amplification des centrosomes dans la régulation du caractère souche et de l’hétérogénéité des cellules cancéreuses.
L’asymétrie centrosomique comme facteur de l’instabilité chromosomique cancéreuse et de l’hétérogénéité intra-tumorale
L’hétérogénéité intratumorale est fréquente dans la plupart des types de cancer avec des implications pronostiques et thérapeutiques importantes. La présence de sous-populations de cellules cancéreuses génétiquement distinctes dans une masse tumorale est considérée comme l’un des principaux moteurs de la progression du cancer, ainsi que la résistance aux thérapies / rechutes. Des analyses avancées de séquençage de l’ADN à l’échelle du génome et en cellule unique de tissus cancéreux dérivés de patients et de cellules tumorales isolées ont généré des portraits complets de la diversité des altérations génétiques parmi des variantes distinctes de cellules cancéreuses au sein d’une masse tumorale1.
Dans un contexte plus large, la diversité génétique est causée par l’instabilité génomique due aux dommages à l’ADN induits par des oncogènes et au dysfonctionnement de la réparation de l’ADN2. Cette diversité peut être encore exacerbée par les pressions sélectives exercées par le stress métabolique et la chimiothérapie3. L’instabilité génomique conduit à l’instabilité chromosomique (chromosome instability, CIN) et à l’aneuploïdie (définie comme des gains, des pertes ou des réarrangements de régions chromosomiques), permettant les sauts macro-évolutifs nécessaires à l’évolution tumorale et aux métastases4. Les aberrations chromosomiques surviennent également fréquemment lors de la culture de cellules souches pluripotentes humaines induites (hiPSC) et de cellules souches embryonnaires humaines (hESC), ou de cellules souches somatiques et représentent un obstacle majeur à leur utilisation pour la médecine régénérative5,6. Fait intéressant, les cellules souches dérivées de différents tissus ont des bras chromosomiques particuliers qui sont prédisposés aux aberrations chromosomiques6, peut-être en raison d’architectures de chromatine distinctes associées à certains états de différenciation7.
La CIN dans les cellules souches et le cancer peuvent tous deux survenir en raison de l’amplification des centrosomes. L’amplification des centrosomes, l’acquisition de centrosomes >2 par une cellule, est une caractéristique fréquente du cancer et est généralement plus fréquente dans les cancers de haut grade8. Les centrosomes sont les centres d’organisation des microtubules (MTOC) de la cellule animale. Il s’agit d’une paire d’organelles qui, par la formation d’un complexe d’anneaux gamma-tubuline, nucléent des microtubules, dictant ainsi la forme cellulaire, la polarité, la motilité, la formation du fuseau, la ségrégation chromosomique et, finalement, la division cellulaire9. Mécaniquement, les centrosomes surnuméraires provoquent une aneuploïdie en augmentant le nombre de pôles du fuseau formés pendant la mitose; cela se produit en raison de l’augmentation des attachements mérotéliques – un type d’erreur dans la liaison fuseau-chromosome par laquelle un seul cinétochore est attaché par erreur à des microtubules rayonnant à partir de plusieurs pôles de fuseau, entraînant un retard de chromosomes pendant l’anaphase10.
Les centrosomes sont structurellement amorphes, composés d’une paire de centrioles incorporés dans des « matériaux péricentriolaires » (PCM) qui contiennent environ 100 protéines différentes11. Une cellule non proliférante contient un centrosome composé de deux centrioles, qui est généralement ancré à la base des cils primaires9. En entrant dans le cycle cellulaire, les deux centrioles se désengagent et mûrissent en reproduisant un deuxième centriole tout en accumulant des PCM11. Dans la plupart des cellules, la maturation des deux centrosomes se produit à des rythmes similaires. Dans les modèles de cellules souches, cependant, un seul centrosome accumule des PCM pendant l’interphase, ce qui entraîne une légère asymétrie temporelle dans la formation des deux fuseaux mitotiques12. Ces caractéristiques uniques sont d’une grande importance pour un mode spécialisé de division cellulaire connu sous le nom de division cellulaire asymétrique (ACD).
L’asymétrie centrosomique coordonne la division asymétrique des cellules souches
Dans des conditions physiologiques, la morphogenèse tissulaire est dictée par un équilibre entre l’auto-renouvellement et la différenciation des cellules souches et est étroitement régulée par des divisions cellulaires symétriques et asymétriques (figure 1). L’ACD, qui est entraînée à la fois par des facteurs extrinsèques (provenant de l’extérieur de la cellule tels que les facteurs paracrines sécrétés par la niche des cellules souches) ou intrinsèques (présents dans la cellule souche elle-même), est un déterminant essentiel pour le devenir des cellules souches de mammifères en régulant la production de cellules souches et en différenciant les cellules filles (examiné en 13).
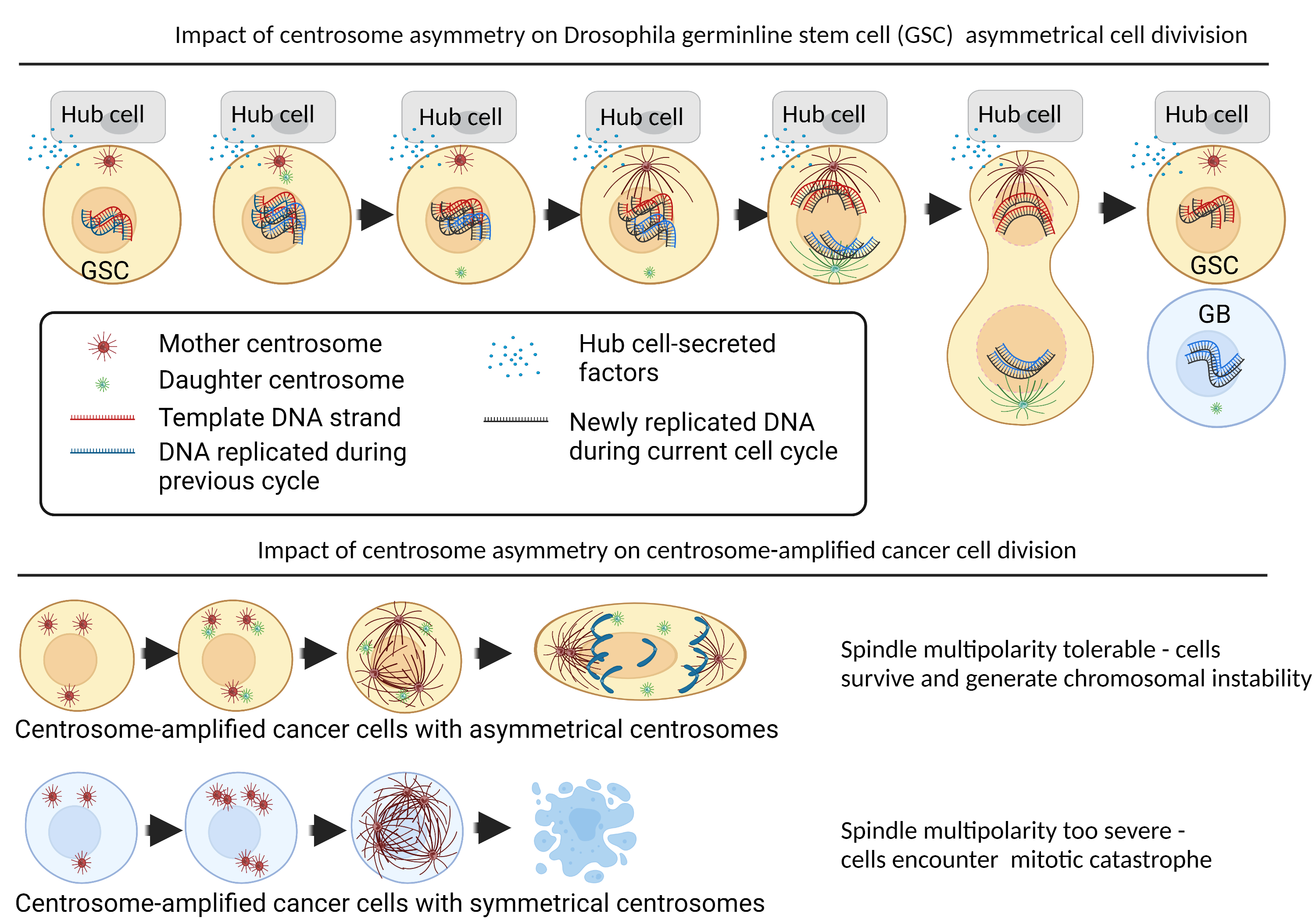
Figure 1 : Impact de l’asymétrie des centrosomes dans les cellules souches et les cellules cancéreuses avec amplification centrosomiques. La division cellulaire asymétrique est entraînée par des facteurs extrinsèques provenant de l’extérieur de la cellule (tels que des facteurs paracrines sécrétés par la niche des cellules souches) et des facteurs intrinsèques provenant d’asymétries inhérentes présentes dans la cellule souche elle-même. Une grande partie de l’étude de la division cellulaire asymétrique est menée dans des modèles de drosophiles. Dans les cellules souches germinales (GSC) de la drosophile, les GSC interagissent avec la niche des cellules souches (ou « hub cells ») par l’intermédiaire de jonctions adhérentes. La cellule centrale sécrète des facteurs tels que Dpp et Upd pour dicter l’organisation des microtubules astraux (microtubules qui s’étendent des centrosomes au cortex de la membrane cellulaire) pour dicter le positionnement du centrosome et l’orientation du fuseau mitotique. Ce mécanisme a deux fonctions connues. Tout d’abord, il maintient la position de la GSC près de la niche, tandis que la deuxième cellule fille – appelée gonial blast (GB) – est isolée des signaux de niche et donc poussée à la différenciation14. Deuxièmement, les centrosomes asymétriques coordonnent les processus au centromère, ce qui permet à la GSC de conserver tout l’ADN matrice lors de la division cellulaire asymétrique, ce qui réduirait la propagation des erreurs de copie de l’ADN12. Dans nos résultats non publiés, nous avons constaté que certaines cellules cancéreuses pouvaient tirer parti de mécanismes rappelant fortement les modèles de centrosomes de cellules souches de la drosophile. Contrairement aux cellules souches, ces cellules cancéreuses présentent une fréquence élevée d’amplification centrosomique. Les cellules cancéreuses avec des centrosomes asymétriques pourraient maintenir la multipolarité du fuseau à un niveau tolérable pour pouvoir compléter la mitose, ce qui entraînerait la survie des cellules avec un degré élevé d’instabilité chromosomique. Les cellules cancéreuses dont les centrosomes symétriques étaient plus sujets à la catastrophe mitotique, et ont donc été éliminées avant de pouvoir propager l’instabilité chromosomique. Figure créée à l’aide de Biorender.com.
La décision fixant laquelle des deux cellules filles acquerra un caractère souche au cours de l’ACD dépend en partie des signaux de polarisation cellulaire dans la niche13. Par exemple, dans les neuroblastes de drosophiles, les déterminants du devenir cellulaire sont intrinsèquement séparés en deux pôles cellulaires pendant l’interphase en fonction des signaux de polarité de la couche de cellules épithéliales. Ces déterminants polarisés du destin cellulaires (p. ex., Par3/par6) capturent des microtubules émanant d’un centrosome spécifique (p. ex. centrosome fille) pour diriger le fuseau mitotique parallèlement à l’axe apical-basal.
À l’heure actuelle, l’asymétrie centrosomique soutient le maintien du phénotype des cellules souches de deux manières clés. Premièrement, en contrôlant l’orientation du fuseau, l’asymétrie des centrosomes peut faire en sorte qu’une seule des cellules filles reste près de la niche des cellules souches (p. ex., les « Hub cells »), tandis que la deuxième cellule fille est positionnée plus loin et donc prédisposée à la différenciation par la perte du signal environnemental nécessaire au maintien de l’identité des cellules souches14. Deuxièmement, l’asymétrie centrosomique se coordonne avec les protéines situées au niveau des centromères (région spécialisée du chromosome qui se fixe au fuseau mitotique) pour s’assurer que la cellule fille avec un caractère souche hérite également de tout le brin d’ADN modèle (original), limitant ainsi la propagation des erreurs de réplication de l’ADN12.
L’instabilité chromosomique survient lorsque la mitose réussit malgré l’amplification des centrosomes
L’amplification centrosomique peut résulter de plusieurs mécanismes qui ne s’excluent pas mutuellement. Les erreurs dans le cycle des centrosomes peuvent entraîner une multiplication excessive des centrioles ou une genèse de nouveaux centrioles, tandis que des erreurs dans la cytocinèse peuvent générer des cellules polyploïdes avec des paires supplémentaires de centrosomes15. Bien que la formation de fuseaux multipolaires favorise la CIN/aneuploïdie, la mitose multipolaire (où une cellule se divise en trois cellules filles ou plus) conduit presque toujours à des cellules non viables16. Les cellules cancéreuses évitent cette catastrophe en empêchant les fuseaux multipolaires de progresser au-delà de la métaphase; au lieu de cela, un processus appelé « regroupement de centrosomes » est utilisé par les cellules cancéreuses pour assembler des fuseaux mitotiques dans l’un des deux pôles17. Le « fuseau pseudobipolaire » qui en résulte conserve les attaches mérotéliques entre les fuseaux/ cinétochore sans s’engager dans une mitose multipolaire, propageant ainsi efficacement la CIN/aneuploïdie tout en générant des cellules filles viables.
L’asymétrie centrosomique rencontre l’amplification des centrosomes dans les cellules souches cancéreuses
Bien que la nature précise des cellules souches cancéreuses ait été difficile à identifier, en particulier in vivo, il existe de nombreuses preuves à l’appui de l’idée que certaines cellules cancéreuses manifestent des traits physiologiquement limités aux cellules souches/progénitrices18. Dans le contexte des centrosomes, cela soulève une question intéressante quant à ce qui se passe lorsque l’asymétrie et l’amplification des centrosomes se manifestent simultanément dans les cellules malignes.

Figure 2: L’inhibition de l’asymétrie du centrosome favorise la maturation du centrosome surnuméraire. En haut : Les cellules cancéreuses peuvent présenter simultanément une asymétrie et une amplification des centrosomes, après quoi certains centrioles, mais pas tous, ne parviennent pas à accumuler du matériel péricentriolaire pendant l’interphase. En bas: L’inhibition des facteurs d’asymétrie des centrosomes, caractérisés comme des facteurs qui empêchent l’asymétrie des centrosomes et la division cellulaire asymétrique dans les cellules à deux centrosomes, produit des centrosomes surnuméraires qui mûrissent uniformément.
Dans des travaux non publiés, utilisant le cancer anaplasique de la thyroïde, une malignité hautement dédifférenciée et aneuploïde, nous montrons que l’asymétrie et l’amplification des centrosomes peuvent coexister et est une propriété que les cellules cancéreuses peuvent exploiter pour promouvoir la CIN. Les cellules cancéreuses atteignent cette aneuploïdie en utilisant des mécanismes favorisant l’asymétrie centrosomique pour limiter la maturation des centrosomes surnuméraires au début de la mitose (figure 2: panneaux supérieurs, démontrant l’abondance de centrioles qui ne parviennent pas à se répliquer et à acquérir des PCM), ce qui est suffisant pour retarder l’activation des centrosomes surnuméraires (figure 3: panneaux supérieurs, démontrant la présence de centrosomes à faible capacité de formation de fuseau). Le ciblage des facteurs d’asymétrie des centrosomes a limité à la fois les caractéristiques de CIN et les caractéristiques de type souche (figures 2-3, panneaux inférieurs). Nos résultats ont illustré un lien de causalité entre l’asymétrie des centrosomes et la CIN dans le contexte du cancer.

Figure 3: L’inhibition de l’asymétrie du centrosome favorise les fuseaux multipolaires par rapport aux fuseaux pseudobipolaires. En haut : les cellules cancéreuses présentant à la fois une asymétrie et une amplification du centrosome peuvent former efficacement des fuseaux pseudobipolaires en limitant l’activation des centrosomes surnuméraires. En bas: L’inhibition des facteurs d’asymétrie des centrosomes réactive le centrosome, ce qui entraîne une augmentation de la multipolarité du fuseau.
En résumé, la compréhension de la façon dont les cellules souches équilibrent l’auto-renouvellement et la production de cellules qui se différencient est un élément clé dans notre compréhension des caractéristiques des cellules souches dans le cancer et de leur contribution à l’hétérogénéité intra tumorale. Bien que l’orientation du fuseau et la ségrégation différentielle des centrosomes/centromères/ADN dans les cellules à division asymétrique soient un mécanisme important pour spécifier les décisions relatives au devenir des cellules, il reste de multiples lacunes et défis non résolus qui doivent être étudiés dans le domaine du cancer avant de mettre en œuvre des stratégies de traduction clinique. Il ne fait aucun doute que les études visant à aborder les relations entre la plasticité des cellules cancéreuses, les aberrations des centrosomes (connues pour être fortement dépendantes du contexte tissulaire / cellulaire) et l’hétérogénéité cellulaire génétique inhérente par rapport à l’hétérogénéité génétique acquise sont d’une importance capitale.
Références
1. Chung, W., et al. Single-cell RNA-seq enables comprehensive tumour and immune cell profiling in primary breast cancer. Nature communications 8, 1-12 (2017).
2. Burrell, R.A., McGranahan, N., Bartek, J. & Swanton, C. The causes and consequences of genetic heterogeneity in cancer evolution. Nature 501, 338-345 (2013).
3. Kinker, G.S., et al. Pan-cancer single-cell RNA-seq identifies recurring programs of cellular heterogeneity. Nature genetics 52, 1208-1218 (2020).
4. McGranahan, N. & Swanton, C. Clonal heterogeneity and tumor evolution: past, present, and the future. Cell 168, 613-628 (2017).
5. Mayshar, Y., et al. Identification and classification of chromosomal aberrations in human induced pluripotent stem cells. Cell stem cell 7, 521-531 (2010).
6. Ben-David, U., Mayshar, Y. & Benvenisty, N. Large-scale analysis reveals acquisition of lineage-specific chromosomal aberrations in human adult stem cells. Cell stem cell 9, 97-102 (2011).
7. Dixon, J.R., et al. Chromatin architecture reorganization during stem cell differentiation. Nature 518, 331-336 (2015).
8. Chan, J.Y. A clinical overview of centrosome amplification in human cancers. International journal of biological sciences 7, 1122 (2011).
9. Nigg, E.A. & Stearns, T. The centrosome cycle: centriole biogenesis, duplication and inherent asymmetries. Nature cell biology 13, 1154-1160 (2011).
10. Cimini, D. Merotelic kinetochore orientation, aneuploidy, and cancer. Biochimica et Biophysica Acta (BBA)-Reviews on Cancer 1786, 32-40 (2008).
11. Jakobsen, L., et al. Novel asymmetrically localizing components of human centrosomes identified by complementary proteomics methods. The EMBO journal 30, 1520-1535 (2011).
12. Ranjan, R., Snedeker, J. & Chen, X. Asymmetric centromeres differentially coordinate with mitotic machinery to ensure biased sister chromatid segregation in germline stem cells. Cell stem cell 25, 666-681. e665 (2019).
13. Yamashita, Y.M., Mahowald, A.P., Perlin, J.R. & Fuller, M.T. Asymmetric inheritance of mother versus daughter centrosome in stem cell division. Science (New York, N.Y.) 315, 518-521 (2007).
14. Venkei, Z.G. & Yamashita, Y.M. Emerging mechanisms of asymmetric stem cell division. Journal of Cell Biology 217, 3785-3795 (2018).
15. Fukasawa, K. Centrosome amplification, chromosome instability and cancer development. Cancer letters 230, 6-19 (2005).
16. Ganem, N.J., Godinho, S.A. & Pellman, D. A mechanism linking extra centrosomes to chromosomal instability. Nature 460, 278-282 (2009).
17. Quintyne, N.J., Reing, J.E., Hoffelder, D.R., Gollin, S.M. & Saunders, W.S. Spindle multipolarity is prevented by centrosomal clustering. Science (New York, N.Y.) 307, 127-129 (2005).
18. Kreso, A. & Dick, J.E. Evolution of the cancer stem cell model. Cell stem cell 14, 275-291 (2014).
