MRM Insights : Cellules épendymaires humaines – le développement d’un protocole iPSC

Yue Zhang

Jo Anne Stratton
Chaque mois, dans les MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, Jo Anne Stratton, Professeure adjointe au Département de neurologie et neurochirurgie à l’université McGill et chercheuse à l’Institut-hôpital neurologique de Montréal, et Yue Zhang, candidate au doctorat dans son laboratoire, nous expliquent comment dériver des cellules épendymaires trouvées dans le cerveau à partir de cellules souches pluripotentes inductibles humaines.
Cellules épendymaires humaines : le développement d’un protocole iPSC
Les cellules gliales sont le type de cellule le plus abondant et le plus diversifié du système nerveux central (SNC). Initialement censées ne soutenir que les neurones, les cellules gliales ont prouvé qu’elles jouent un rôle essentiel dans la physiologie et la pathologie du cerveau. Les cellules épendymaires sont l’une de ces glies qui constituent la couche épithéliale, tapissant l’ensemble du système ventriculaire rempli de liquide céphalorachidien (LCR), ce qui rend les cellules épendymaires intimement liées au LCR, où elles jouent un rôle clé dans la régulation de la dynamique du LCR1. Cela comprend la régulation du flux de LCR via des cils mobiles qui battent de manière coordonnée pour déplacer le LCR dans les ventricules2,3. Une perturbation de la circulation du LCR est détectée dans les maladies neurologiques, ce qui contribue à une accumulation de déchets neurotoxiques et aggrave les processus pathologiques4-6.
Il y a un manque de systèmes de modélisation robustes pour explorer le rôle des cellules épendymaires dans la santé et la maladie. En effet, le domaine repose en grande partie sur les systèmes de rongeurs pour étudier ces cellules, et parce que les cellules épendymaires matures isolées directement du cerveau adulte ne parviennent pas à survivre ou à proliférer in vitro, on s’appuie majoritairement sur des systèmes de culture néonatale pour étudier ces cellules in vitro7. Les progéniteurs de cellules épendymaires (ou glie radiale) sont dérivés de rongeurs néonatals et sont ensuite incités à se différencier en cellules épendymaires matures in vitro pour leur étude ultérieure7,8. Bien qu’utiles, les cellules épendymaires de rongeurs ne récapitulent pas complètement la biologie humaine et, malheureusement, il n’existe pas de tests humains robustes pour étudier les cellules épendymaires humaines.
Les cellules souches pluripotentes induites humaines (induced pluripotent stem cells, iPSC) sont un outil précieux pour étudier le développement humain, modéliser les conditions physiologiques ou pathologiques et fournir une source cellulaire pour la découverte de médicaments. Il existe des protocoles permettant de dériver un grand nombre de types de cellules à partir d’iPSC reprogrammées, y compris des cellules du SNC comme les neurones, les astrocytes, les oligodendrocytes et les microglies9-12, mais de tels protocoles n’existent pas pour les cellules épendymaires. Les cellules épendymaires sont dérivées de la glie radiale qui sont des progénitrices bipolaires allongées qui apparaissent dans le cerveau lorsque le télencéphale commence à devenir un épithélium pluristratifié et forment une couche entre la zone ventriculaire (VZ) et la préplaque13,14. Imitant le processus in vivo de production de glie radiale, d’autres ont généré des protocoles iPSC pour permettre la génération de glie radiale iPSC15. Notre objectif est d’étendre ces protocoles pour générer des cellules épendymaires, une étape importante pour la création d’un test iPSC humain in vitro pour étudier les cellules épendymaires dans la santé et la maladie (Figure 1).
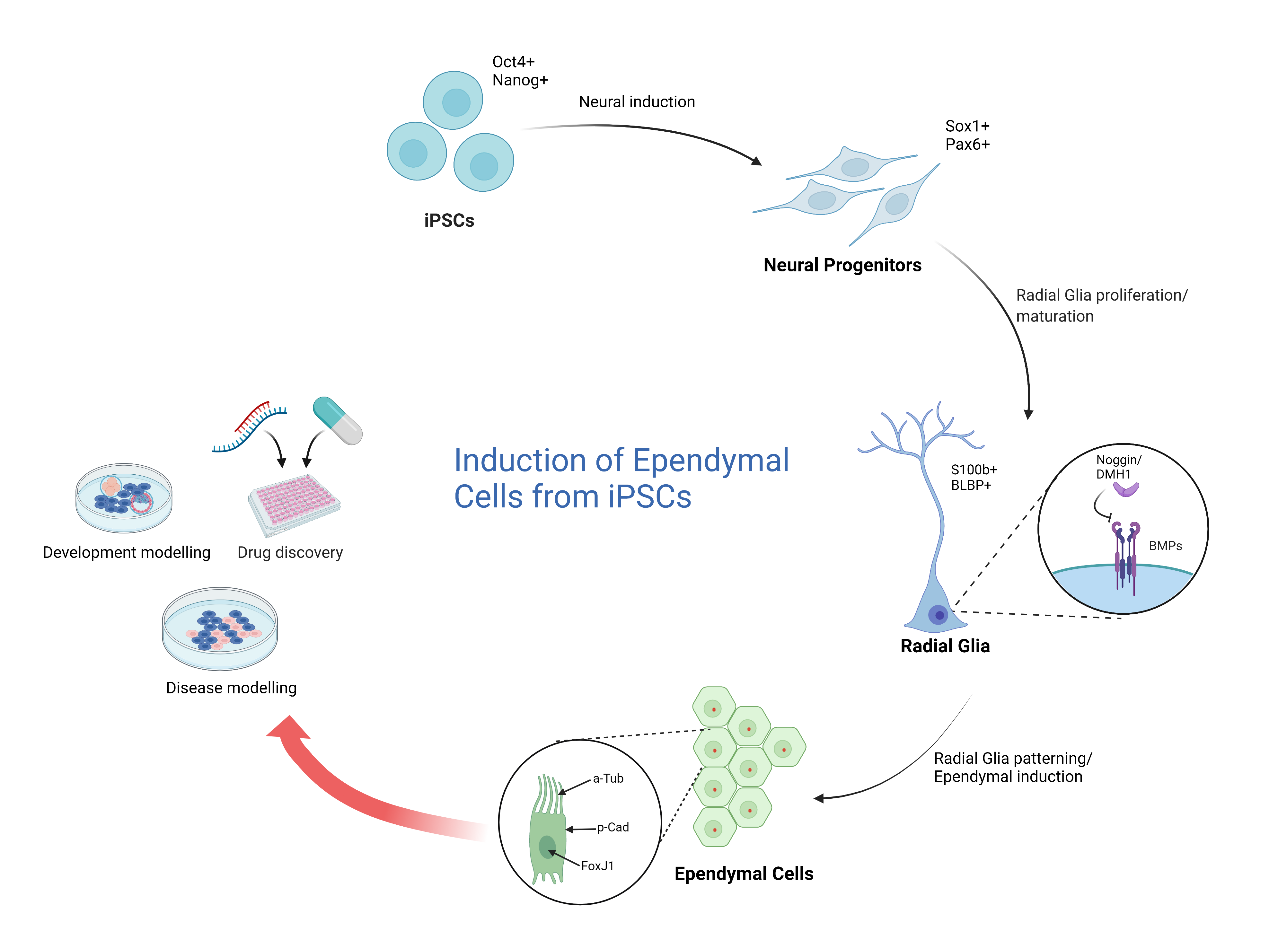
Figure 1
Afin de différencier la glie radiale en cellules épendymaires, les signaux définis que ces cellules reçoivent au cours du développement mi-fœtal doivent être récapitulés, par exemple la protéine morphogénétique osseuse (BMP), qui est un facteur de croissance neuronale, doit être absente. Normalement, la signalisation BMP est importante pendant le développement neuronal dorsal au cours du développement mi-fœtal, mais largement absente dans les régions ventrales où les cellules épendymaires se développent16. En effet, l’inhibition du BMP entraîne la génération d’un grand nombre de centrioles qui migrent vers la membrane plasmique et deviennent les corps basaux des cils mobiles17. En tant que tel, nous prédisons que l’inhibition de la signalisation BMP à l’aide d’antagonistes BMP comme Noggin ou DMH1 dans la glie radiale iPSC entraînera la formation de cils importants pour la maturation des cellules épendymaires18. En outre, nous visons également à retirer tous les mitogènes et à ajouter un inhibiteur de néddylation, MLN-4924, qui stabilise le facteur de transcription, Foxj1 (protéine J 1) – le facteur de transcription maître impliqué dans la ciliogenèse19. MLN-4924 stabilise la protéine FOXJ1 en inhibant sa dégradation par la voie protéasomale, ce qui entraîne la génération de populations cellulaires épendymaires stables in vitro3. Avec ces modifications, nous espérons créer un système robuste de culture de cellules épendymaires iPSC que nous caractériserons à l’aide de la coloration immunofluorescente, de l’immunocytochimie, du phénotypage transcriptionnel et des tests fonctionnels.
Le développement d’une méthode de génération de cultures de cellules épendymaires à partir d’iPSC d’origine humaine est sans précédent. Il nous aidera à mieux comprendre le développement des cellules épendymaires et soutiendra nos recherches sur l’évaluation des cellules épendymaires dans les domaines de la santé et de la maladie20.
Références
1. MacDonald, A. et al. Single Cell Transcriptomics of Ependymal Cells Across Age, Region and Species Reveals Cilia-Related and Metal Ion Regulatory Roles as Major Conserved Ependymal Cell Functions. Front. Cell. Neurosci. 15, (2021).
2. Del Bigio, M. R. The ependyma: a protective barrier between brain and cerebrospinal fluid. Glia 14, 1–13 (1995).
3. Abdi, K. et al. Uncovering inherent cellular plasticity of multiciliated ependyma leading to ventricular wall transformation and hydrocephalus. Nat. Commun. 9, (2018).
4. Reeves, B. C. et al. Glymphatic System Impairment in Alzheimer’s Disease and Idiopathic Normal Pressure Hydrocephalus. Trends Mol. Med. 26, 285–295 (2020).
5. Louveau, A. et al. Understanding the functions and relationships of the glymphatic system and meningeal lymphatics. J. Clin. Invest. 127, 3210–3219 (2017).
6. Ma, Q., Ineichen, B. V., Detmar, M. & Proulx, S. T. Outflow of cerebrospinal fluid is predominantly through lymphatic vessels and is reduced in aged mice. Nat. Commun. 8, (2017).
7. Shah, P. T. et al. Single-Cell Transcriptomics and Fate Mapping of Ependymal Cells Reveals an Absence of Neural Stem Cell Function. Cell 173, 1045-1057.e9 (2018).
8. Gabrion, J. B. et al. Ependymal and choroidal cells in culture: Characterization and functional differentiation. Microsc. Res. Tech. 41, 124–157 (1998).
9. Hasselmann, J. & Blurton-Jones, M. Human iPSC-derived microglia: A growing toolset to study the brain’s innate immune cells. Glia 68, 721–739 (2020).
10. Emdad, L., D’Souza, S. L., Kothari, H. P., Qadeer, Z. A. & Germano, I. M. Efficient differentiation of human embryonic and induced pluripotent stem cells into functional astrocytes. Stem Cells Dev. 21, 404–410 (2012).
11. TCW, J. et al. An Efficient Platform for Astrocyte Differentiation from Human Induced Pluripotent Stem Cells. Stem cell reports 9, 600–614 (2017).
12. Hu, B. Y. & Zhang, S. C. Differentiation of spinal motor neurons from pluripotent human stem cells. Nat. Protoc. 4, 1295–1304 (2009).
13. Malatesta, P., Appolloni, I. & Calzolari, F. Radial glia and neural stem cells. Cell Tissue Res. 331, 165–178 (2008).
14. Redmond, S. A. et al. Development of Ependymal and Postnatal Neural Stem Cells and Their Origin from a Common Embryonic Progenitor. Cell Rep. 27, 429-441.e3 (2019).
15. Duan, L., Peng, C.-Y., Pan, L. & Kessler, J. A. Human Pluripotent Stem Cell-Derived Radial Glia Recapitulate Developmental Events and Provide Real-Time Access to Cortical Neurons and Astrocytes. Stem Cells Transl. Med. 4, 437–447 (2015).
16. Wurst, W., Bally-Cuif, L. & Bally-Cuif, L. Neural plate patterning: Upstream and downstream of the isthmic organizer. Nat. Rev. Neurosci. 2001 22 2, 99–108 (2001).
17. Delgehyr, N. et al. Ependymal cell differentiation, from monociliated to multiciliated cells. Methods Cell Biol. 127, 19–35 (2015).
18. Hiraoka, K., Inada, H., Yanai, K. & Osumi, N. Bone Morphogenetic Proteins Inhibit Ciliogenesis of Ependymal Cells in Vitro. Tohoku J. Exp. Med. 252, 199–208 (2020).
19. Jacquet, B. V. et al. FoxJ1-dependent gene expression is required for differentiation of radial glia into ependymal cells and a subset of astrocytes in the postnatal brain. Development 136, 4021–4031 (2009).
20. Hatrock, D., Caporicci-Dinucci, N. & Stratton, J. Ependymal cells and multiple sclerosis: proposing a relationship. Neural Regen. Res. 15, 263–264 (2020).
Crédit photo : avec l’aimable autorisation de Dale Hatrock.
