MRM Insights : Oligodendrocytes dérivés d’IPSC – un modèle de potentiel de régénération dans la SEP ?

Valerio Piscopo

Thomas Durcan

Gabriela Blaszczyk

Jack Antel
Chaque mois, dans les MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, Jack Antel, Professeur de neurologie et de neurochirurgie au Neuro et à l’Université McGill, Gabriela Blaszczyk, étudiante de 1er cycle dans son laboratoire, Thomas Durcan, Professeur agrégé au Neuro et à l’Université McGill, Directeur de la PDMPP (EDDU), et Valerio Piscopo, Associé de recherche à la PDMPP, nous parlent des oligodendrocytes dérivés d’iPSC comme d’un modèle du potentiel de régénération dans la sclérose en plaque.
Oligodendrocytes dérivés d’IPSC – un modèle de potentiel de régénération dans la SEP ?
Les oligodendrocytes (OL) sont une population de cellules gliales qui produisent de la myéline autour des axones, permettant une transduction efficace du signal dans le système nerveux central (SNC). Les OL fournissent un soutien trophique essentiel aux neurones. La caractéristique pathologique de la sclérose en plaques (SEP) est la destruction de la myéline. La phase initiale de l’évolution de la SEP est caractérisée par des rechutes récurrentes de dysfonctionnement neurologique résultant de lésions démyélinisantes associées à une inflammation focale avec une épargne relative des corps cellulaires des OL (1). La récupération après ces rechutes est liée au moins en partie à la remyélinisation dans de telles lésions. Au fil du temps, la maladie peut évoluer vers une phase progressive avec une aggravation progressive des symptômes neurologiques; cette phase est associée à la perte de corps cellulaires des OL, à l’incapacité de régénérer la gaine de myéline et à la perte neuronale subséquente (1). La remyélinisation dans le SNC est généralement attribuée au recrutement et à la différenciation des cellules progénitrices oligodendrocytes (OPC) (2), bien que des OL précédemment myélinisants puissent également y contribuer.
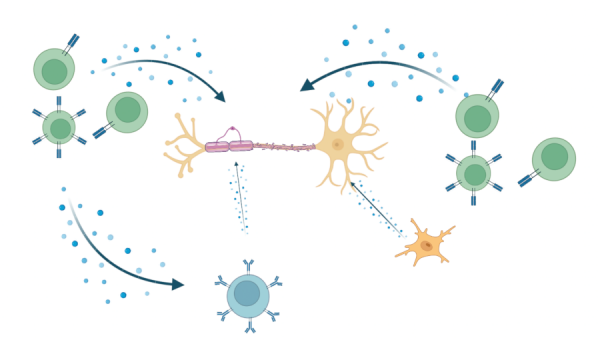
Les mécanismes précis qui sous-tendent les processus de blessure et de réparation dans la SEP restent à définir. Les constituants de l’inflammation qui peuvent être dérivés de l’infiltration des cellules immunitaires, ainsi que des astrocytes activés et la microglie sont impliqués en tant que médiateurs dans les processus de blessure (Fig 1). Les conditions dans le microenvironnement des lésions de SEP créent un stress métabolique sur les OL. Le succès de la réparation de la myéline a été lié à la production de facteurs trophiques essentiels et à la résolution des conditions inhibitrices locales. Des modèles animaux, tels que l’encéphalomyélite auto-immune expérimentale (EAE) et la démyélinisation induite par les toxines, ont été développés pour évaluer à la fois les processus de blessure et de réparation associés à la SEP.
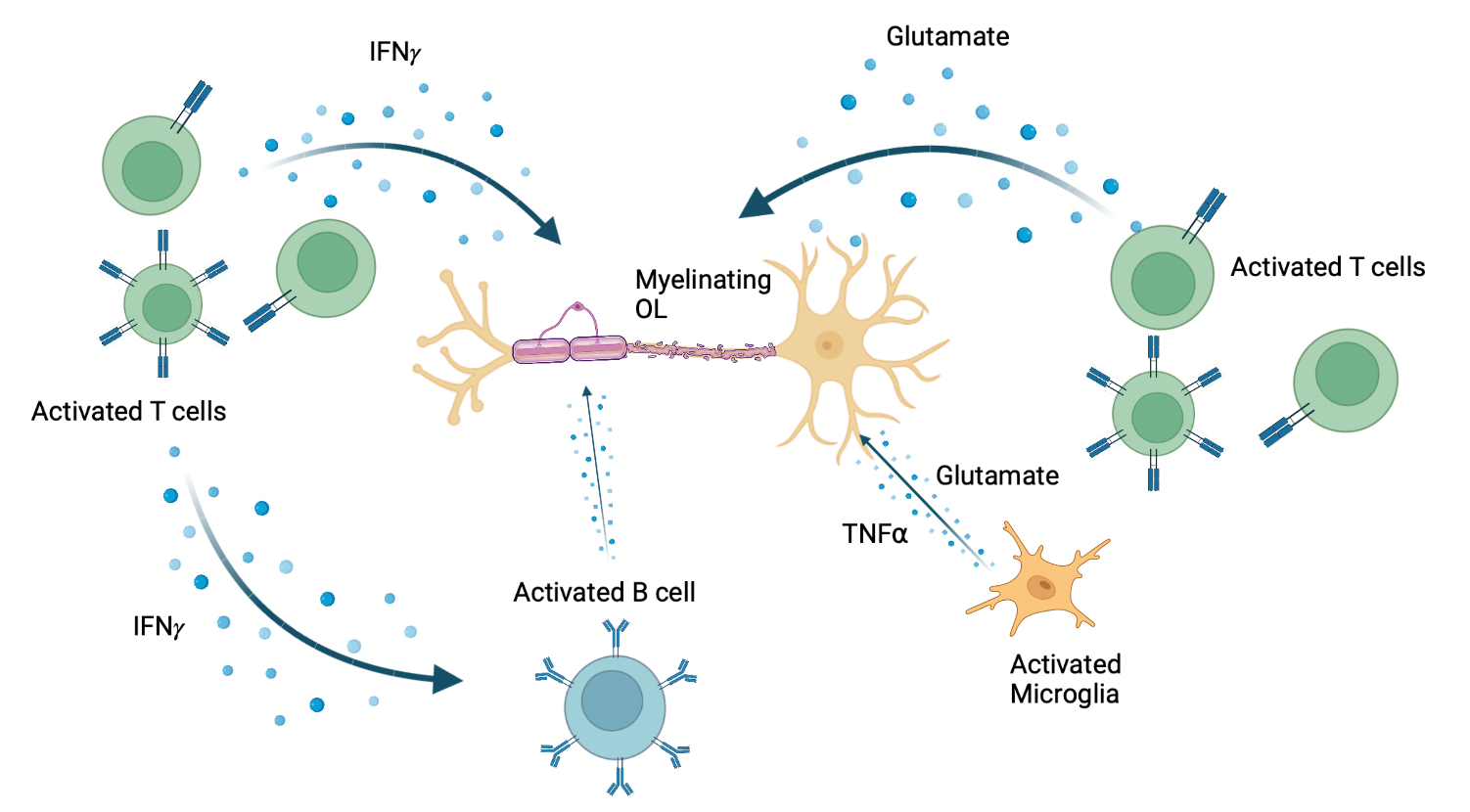
Figure 1.Libération de molécules pro-inflammatoires qui agissent sur les OL lors de la formation de lésions de SEP. Fabriqué avec BioRender. Adapté de : Wu GF, Alvarez E. Neurol Clin. 2011. Levite M. J Neural Transm (Vienna). 2017. Frigo M, et al. Curr Med Chem. 2012
Un défi permanent consiste à démontrer les caractéristiques moléculaires spécifiques des OL humains qui sous-tendent leur susceptibilité aux blessures et leur capacité à effectuer des réparations. L’analyse directe des tissus touchés par la SEP fournit des indices, mais elle est limitée en ce qui concerne la définition des aspects dynamiques des processus de blessure et de réparation. L’accès aux OL humains primaires pour les études fonctionnelles et moléculaires est également limité, bien qu’il soit mené dans le cadre de notre programme grâce aux efforts de collaboration des Départements de neurochirurgie adulte et pédiatrique de McGill et du Programme de neuroimmunologie du Neuro (3).
L’une des approches émergentes pour faire progresser notre compréhension des propriétés de blessure / réparation des OL humains implique l’utilisation de cellules souches pluripotentes induites humaines (iPSC), car elles peuvent être facilement dérivées de cellules somatiques de patients et peuvent se différencier en tous les types de cellules (4). Cette approche est utilisée par la collaboration du Programme de neuroimmunologie du Neuro, du programme de science ouverte du Neuro par l’entremise du Référentiel C-BIG (https://www.mcgill.ca/neuro/fr/science-ouverte/referentiel-c-big) et de l’Unité de développement précoce de médicaments (PDMPP) avec le soutien du Réseau MRM. En utilisant un protocole préalablement établi (5), nous pouvons générer efficacement des OPC, ce qui nous permet d’étudier leur susceptibilité aux blessures et les mécanismes potentiels contribuant à leur carence en réparation dans des conditions telles que celles observées dans la SEP.
Nous avons utilisé les OPC dérivés d’iPSC pour faire progresser les études visant à déterminer si et comment les molécules pro-inflammatoires contribuent à la disparition des OL et de leurs précurseurs. Parmi ces molécules, comme illustré à la figure 1, on trouve le glutamate qui peut être libéré par des cellules Th17 activées ou des microglies résidentes; l’interféron gamma (IFNγ), qui peut également être libéré par les lymphocytes T activés, et le facteur de nécrose tumorale-alpha (TNFα) produit par les macrophages activés, les lymphocytes T et les cellules tueuses naturelles (NK) (6 – 8). Jusqu’à présent, les effets de ces molécules ont été explorés in vivo dans des modèles expérimentaux, in vitro en utilisant des lignées d’OL non humains, et dans nos propres études in vitro utilisant des OL humains matures (9). Ces dernières études indiquent que les médiateurs induisent la rétraction des neurites mais pas la mort cellulaire dans les cellules humaines, contrairement aux observations faites avec des cellules progénitrices non humaines. Les études iPSC nous permettent d’évaluer les effets de ces médiateurs tout au long du spectre de la différenciation des cellules OL humaines. En utilisant cette approche, nous observons que l’IFNγ et le TNFα individuellement arrêtent la différenciation des OPC vers les oligodendrocytes, plutôt que d’initier des programmes de mort cellulaire, une découverte en accord avec Staros et coll. qui ont utilisé une approche de reprogrammation génétique pour générer des OL dérivés d’iPSC (10). Ce système de dosage permet d’évaluer un large éventail de molécules dérivées des cellules immunitaires (y compris les cellules B) (11) et des cellules gliales.
Le suivi du stade de développement des OPC in vitro nécessite des analyses immunocytochimiques complexes intermittentes. Pour nous permettre de suivre ces cellules de manière dynamique au fil du temps, le Réseau MRM a spécifiquement soutenu nos efforts pour générer une lignée cellulaire iPSC exprimant un gène rapporteur de lignée OL (SOX10), nous permettant de suivre la différenciation développementale des cellules souches dans et le long de la voie cellulaire OL (Fig. 2A). Cela a été fait à la PDMPP par Zhipeng You et Valerio Piscopo en utilisant la technologie CRISPR / Cas-9. Ces cellules vont maintenant être triées (Fig. 2B) et ajoutées à des plaques spéciales contenant des nanofibres afin de suivre leur potentiel de myélinisation (Fig. 2C).
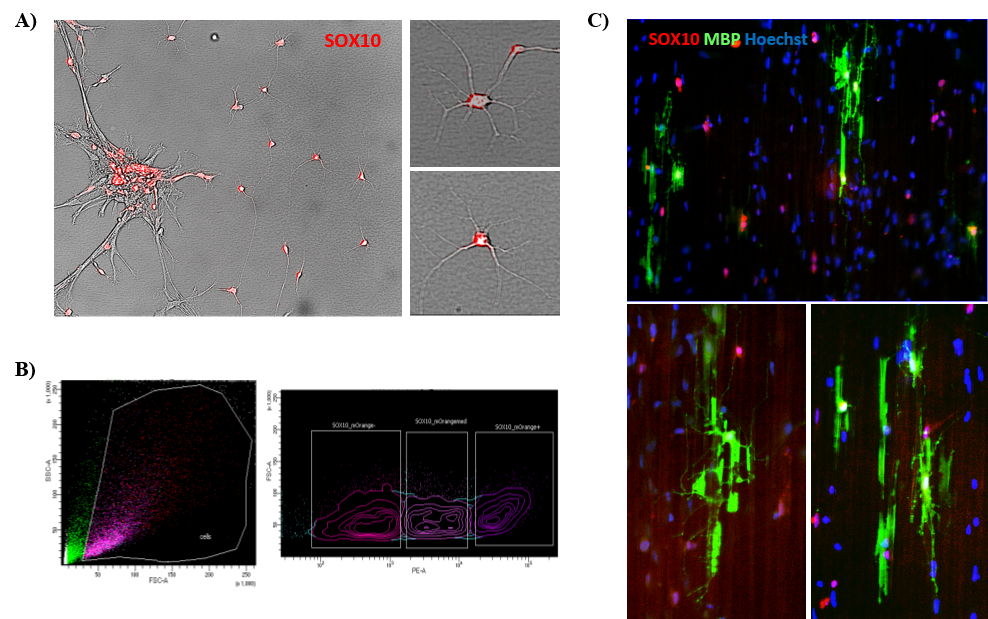
Figure 2. Production de la lignée iPSC SOX10-mOrange reporter. A) Image au microscope des OPC SOX10 positifs, montrant la fluorescence rouge; B) Les cellules sont triées en direct pour l’expression du rapporteur et C) ensemencées sur des plaques de nanofibres pour évaluer la myélinisation, représentée en vert par l’expression de la protéine de base de la myéline (MBP).
Références
1. Heß K, Starost LJ, Kieran NW, Thomas C, Vincenten MCJ, Antel J, Martino G, Huitinga I, Healy L, Kuhlmann T. Lesion stage dependent causes for impaired remyelination in MS. Acta Neuropathol- 2020 Jul 24.
2. Franklin RJ, Ffrench-Constant C. Remyelination in the CNS: from biology to therapy. Nat Rev Neurosci. 2008;9(11):839-855. doi:10.1038/nrn2480
3. Luo JXX, Cui QL, Yaqubi M, Hall JA, Dudley R, Srour M, Addour N, Jamann H, Larochelle C, Blain M, Healy LM, Stratton JA, Sonnen JA, Kennedy TE, Antel JP. Human oligodendrocyte myelination potential; relation to age and differentiation. Ann Neurol. 2022 Feb;91(2):178-191. doi: 10.1002/ana.26288.Epub 2022 Jan 10.
4. Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 2007;131(5):861-872. doi:10.1016/j.cell.2007.11.019
5. Douvaras P, Fossati V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nat Protoc. 2015;10(8):1143-1154. doi:10.1038/nprot.2015.075
6. Larochelle C , Wasser B, Jamann H, Löffel JT, Cui QL, Tastet O, Stratton J, Schillner M, Luchtman D, Birkenstock J, Stroh A, Antel J, Bittner S, and Zipp F. Pro-inflammatory T-helper 17 directly harm oligodendrocytes in neuroinflammation. Proc Natl Acad Sci- 2021 Aug 24;118(34): e2025813118
7. Jamann H, Cui Q, Desu HL, Pernin F, Tastet O, Halaweh A, Farzam-kia N, Mamane VH, Ouédraogo O, Cleret-Buhot A, Daigneault A, Lemaitre F, Arbour N, Antel J, Stratton J, Larochelle C – Contact-dependent granzyme B-mediated cytotoxicity of Th17 cells towards human oligodendrocytes – Frontiers Immunology – in press
8. 8.Moore CS, fi Q, Warsi NM, Durafourt BA, Zorko N, Owen DR, Antel JP, Bar-Or A. Direct and Indirect Effects of Immune and Central Nervous System-Resident Cells on Human Oligodendrocyte Progenitor Cell Differentiation. J Immunol. 2015 Jan 15;194(2):761-72.
9. Pernin F, JXX, Cui QL, Blain M, Fernandes MGF, Yaqubi M, Srour M, Hall J, Dudley R, Jamann H, Larochelle C, Zandee SEJ, Prat A, Stratton J, Kennedy TEK, Antel JP. Diverse injury responses of human oligodendrocyte to mediators implicated in multiple sclerosis -BRAIN – in press
10. Starost L, Lindner M, Herold M, Xu YKT, Drexler HCA, Heß K, Ehrlich M, Ottoboni L, Ruffini F, Stehling M, Röpke A, Thomas C, Schöler HR, Antel J, Winkler J, Martino G, Klotz L, Kuhlmann T Extrinsic immune cell-derived, but not intrinsic oligodendroglial factors contribute to oligodendroglial differentiation block in multiple sclerosis. Acta Neuropathol. 2020 Sep 7.
11. Lisak RP, Benjamins JA, Nedelkoska L, Barger JL, Ragheb S, Fan B, Ouamara N, Johnson TA, Rajasekharan S, Bar-Or A. Secretory products of multiple sclerosis B cells are cytotoxic to oligodendroglia in vitro. J Neuroimmunol. 2012 May 15;246(1-2):85-95.
