MRM Insights : Traduction clinique efficace des cellules souches – du laboratoire à la clinique, au laboratoire

Sangeeth Pillai

Jose Gil Munguia-Lopez

Simon Tran

Mari Kaartinen
Chaque mois, dans les MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, la Professeure agrégée Mari Kaartinen, et le Professeur Simon Tran, de la Faculté de médecine dentaire et des sciences de la santé orale de McGill et leurs étudiants Jose Gil Munguia-Lopez, chercheur postdoctoral, et le candidat à la maîtrise Sangeeth Pillai, nous parlent de traduction clinique efficace des cellules souches.
Traduction clinique efficace des cellules souches – du laboratoire à la clinique, au laboratoire
« Cellules souches » (CS) est un terme générique qui comprend plusieurs types de cellules qui peuvent s’auto-renouveler et se différencier avec un potentiel d’utilisation pour des applications thérapeutiques1. En fonction de leur utilisation clinique et de leur objectif thérapeutique, les CS peuvent être classées en CS somatiques multipotentes de « première génération » telles que les cellules souches hématopoïétiques (CSH) et les cellules souches mésenchymateuses (CSM) ou en cellules souches pluripotentes (CSP) de « deuxième génération » telles que les cellules souches embryonnaires (CSE) et les cellules souches pluripotentes induites (iPSC). Les CS de première génération sont limitées à une lignée et donnent naissance à des types de cellules spécifiques aux tissus. En revanche, les CS de deuxième génération sont pluripotentes et peuvent donner naissance à n’importe quel type de cellule dans le corps2. La combinaison des CS de première et de deuxième génération constitue le cœur de la thérapie à base de CS innovante. Les CSH sont les CS les plus courantes et les plus largement utilisées cliniquement, et des milliers de greffes de moelle osseuse à base de CSH sont effectuées chaque année dans le monde3. Les CSM dérivées de plusieurs sources tissulaires telles que la moelle osseuse, les tissus adipeux, ombilical, dentaires et parodontaux sont testés dans de nombreuses études cliniques à travers le monde4. Il a été démontré que les thérapies à base de CSP sont sûres et tolérées par l’hôte dans les essais cliniques de phase 15,6. Cependant, les thérapies à base de CSE et d’iPSC posent plusieurs défis tels que l’obtention de produits CSP de qualité clinique, la menace de rejet immunitaire et de tumorigénicité, l’hétérogénéité phénotypique, les préoccupations éthiques, etc.
En un mot, pour amener une thérapie à base de CS du laboratoire à la clinique il faut passer par le biais d’études précliniques, telles que des tests sur des cellules ex vivo et sur des animaux. Si ces approches sont un succès, les thérapies peuvent être testées sur des humains dans le cadre d’un essai clinique7,8. Les essais de phase 1 testent l’innocuité et la posologie des thérapies CS chez un petit groupe de personnes. Les essais de phase 2 visent à tester l’efficacité, les effets secondaires et à déterminer la meilleure dose. Les essais de phase 3 testent l’efficacité et surveillent les effets secondaires du traitement à base de CS sur un grand groupe de patients, y compris en le comparant à un traitement couramment utilisé. Si l’essai de phase 3 est réussi, l’organisme de réglementation (comme Santé Canada ou la FDA) autorisera l’utilisation du traitement à base de CS sur le marché. Les essais de phase 4 sont effectués une fois que le traitement est sur le marché afin de surveiller son efficacité et ses effets secondaires dans une population plus large et sur une plus longue période de temps8.
Dans la base de données clinicaltrials.gov des NIH, Trounson et coll., ont rapporté en 20119 123 essais cliniques utilisant des CSM pour diverses applications thérapeutiques. Cette recherche a été répétée par les mêmes chercheurs en 2015 et a révélé une multiplication par trois avec 374 essais enregistrés utilisant des CSM10. Nous avons récemment renouvelé cette recherche en utilisant la base de données des NIH avec le terme de recherche « cellules souches mésenchymateuses » et avons trouvé plus de 1300 essais interventionnels enregistrés rapportant l’utilisation de CSM. Parmi ceux-ci, 1112 essais cliniques ont été classés en essais de phase précoce 1, de phase 1 et / ou de phase 2, 88 études ont été signalées comme étant en phase 3 et, étonnamment, seulement 8 essais cliniques ont été rapportés en phase 4. Ces statistiques indiquent une augmentation alarmante des études basées sur les CSM qui sont enregistrées chaque année avec une traduction très limitée en dehors du pipeline clinique, d’autant que nombre de ces essais sont des études à petite échelle avec des conceptions variables, ce qui rend difficile la réalisation d’une analyse impartiale des résultats11. En plus de ces essais, il existe plusieurs autres traitements non réglementés et produits à base de cellules souches qui sont mis directement à la disposition des consommateurs sans l’approbation des organismes de réglementation12.
Quelle pourrait être la raison de cette perte de traduction vers la clinique ? Il ne fait aucun doute que les cellules souches ont un large éventail d’implications dans l’avancement de l’innovation dans les soins de santé, soit en tant que candidats à la thérapie cellulaire (extraits cellulaires et facteurs paracrines), soit en tant que trousses d’outils dans la modélisation des maladies et la découverte de médicaments (organoïdes). Cependant, cette traduction innovante est principalement mise à mal par nos connaissances partielles, le manque de technologie adéquate et parfois le manque de compréhension des règles qui régissent le caractère souche des cellules. En 2006, l’International Society of Cellular Therapy (ISCT) a recommandé des critères pour définir les CSM multipotentes et a fourni des lignes directrices de base sur la caractérisation minimale des CSM13. Une analyse récente de 84 essais cliniques publiés sur les données de caractérisation des CSM a révélé que : la majorité de ces essais n’ont fourni aucune donnée sur le potentiel de différenciation des CSM; 28 études n’ont rapporté aucune donnée sur la caractérisation cellulaire; 45 études ont rapporté la valeur moyenne des marqueurs cellulaires de quelques lots de cellules utilisées dans les essais, et seulement 6 articles ont défini leur fonctionnalité, ce qui signifiait qu’il n’y avait aucune justification significative au mécanisme d’action prévu des cellules pour la condition traitée14. L’étiquetage des CSM en tant qu’agents thérapeutiques sans preuve définitive de leur potentiel paracrine ou immunomodulateur, dans ce contexte, est trompeur. Le créneau des CS est multiple et donc pour utiliser efficacement leurs capacités thérapeutiques, plusieurs stratégies doivent être utilisées. De plus, ces stratégies et outils (études in vitro/in vivo) devraient être conçus pour évaluer de manière appropriée les CS avec toutes leurs complexités soit au niveau d’une seule CS, d’une population de CS et de leur présence dans des tissus et des systèmes d’organes complexes. Cependant, seuls des groupes de recherche limités sont équipés d’un tel éventail de ressources, d’archétypes de modèles pathologiques et d’expertise pour déconvoluer la nature hautement dynamique et hétérogène des systèmes CS pour une traduction clinique efficace. Tous ces obstacles entravent le succès clinique actuel et à long terme de l’utilisation des CS en thérapie et conduisent souvent à leur commercialisation prématurée.
Plus tôt cette année, les équipes de recherche Kaartinen et Tran de la Faculté de médecine dentaire et des sciences de la santé orale, avec l’appui du Centre de recherche osseuse et parodontale de l’Université McGill, ont présenté une demande de subvention d’infrastructure de la Fondation canadienne pour l’innovation (FCI) afin de créer un nouveau pipeline de recherche pour exploiter et tester le potentiel de régénération des cellules souches osseuses et parodontales et leur modulation thérapeutique. L’idée de l’infrastructure proposée est de soutenir nos programmes de recherche novateurs et nos multiples projets visant l’isolement, l’expansion et la modification (ex vivo et in vivo) des CS, suivis de leur transplantation, pour le génie tissulaire et les applications régénératives visant à améliorer la santé osseuse, parodontale et buccodentaire. Nos programmes de recherche comprennent également la traduction de nos nouvelles connaissances sur les mécanismes de différenciation et le comportement des cellules souches vers la découverte et à la mise à l’essai de nouvelles cibles à des fins thérapeutiques.
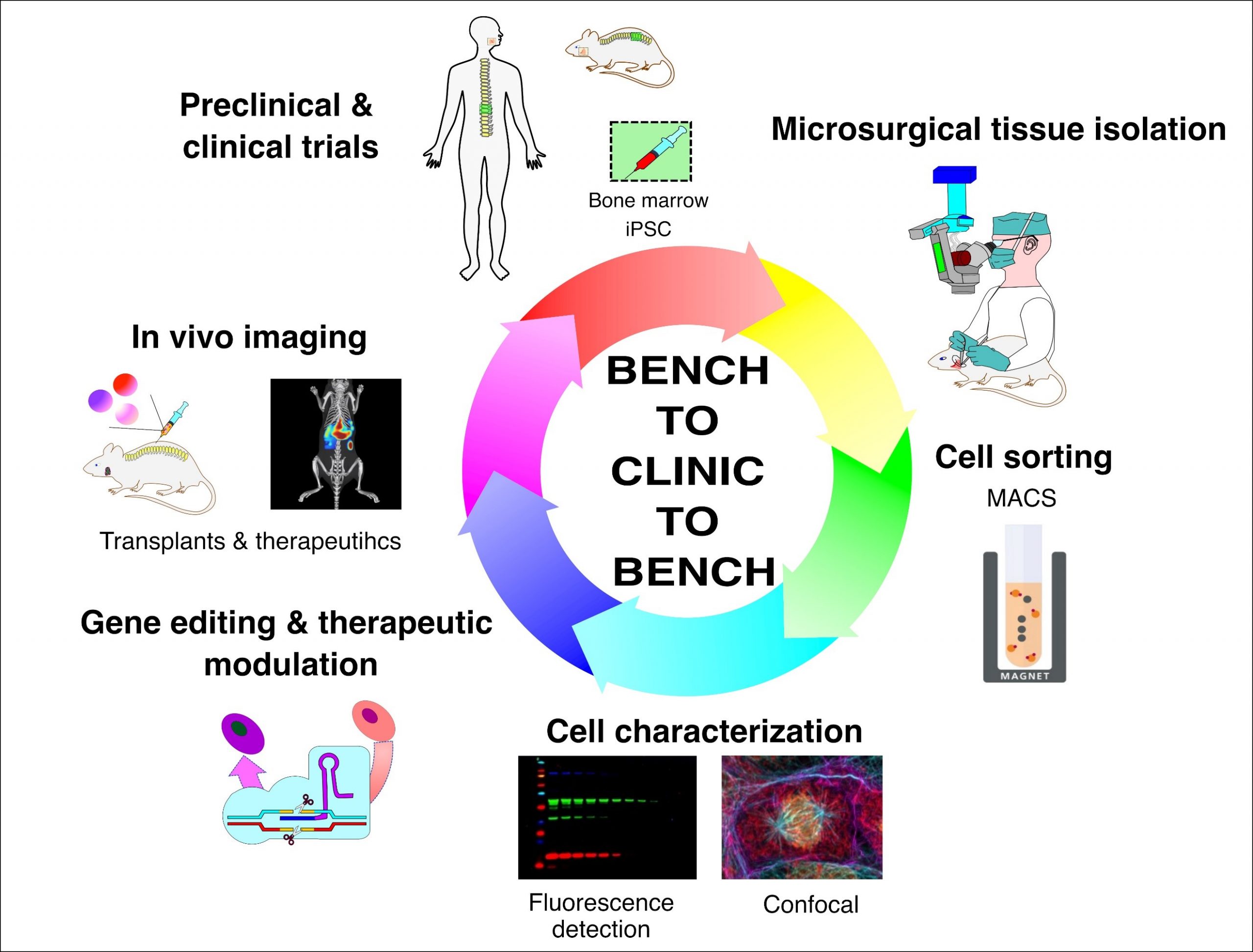
Notre pipeline d’infrastructures laboratoire-clinique-laboratoire proposé pour l’isolement, le tri, la caractérisation, la transplantation et le suivi des cellules souches à l’aide des technologies de pointe actuelles.
Nous avons divisé nos projets de recherche en trois branches spécifiques pour atteindre nos objectifs avec cette infrastructure proposée. Tout d’abord, la branche de génie tissulaire qui se concentre sur le développement de modèles de tissus mous (oraux) et durs (os) ex vivo, in vitro et in vivo, y compris des modèles de maladies. La stratégie proposée d’utiliser les CS à la fois pour développer des modèles ex vivo et en tant qu’agents de thérapie cellulaire utilisera les instruments microchirurgicaux demandés pour disséquer, identifier et isoler avec précision les cellules souches buccales et de moelle osseuse. Toute recherche sur les CS visant une traduction clinique future doit mettre en œuvre des stratégies de purification cellulaire strictes pour valider les CS avant les tests précliniques. Pour répondre à ce critère, nous avons proposé l’utilisation d’un système de tri de cellules magnétiques automatisé et très polyvalent. Deuxièmement, la branche régénérative se concentre sur l’identification et l’isolement des principaux facteurs biologiques actifs / protéines du tissu craniofacial humain et de la souris et des CSM dérivées de la moelle osseuse, y compris les CS labiales et parodontales. Pour atteindre notre objectif d’exploiter le potentiel de régénération des CS en tant qu’agent thérapeutique, et après le développement d’organoïdes, nous visons leur caractérisation biologique et fonctionnelle avec une nouvelle génération, un imageur de fluorescence multimode et un microscope confocal pour les tests in vitro et, après réimplantation, in vivo. Troisièmement, la branche thérapeutique vise à moduler les CS via l’édition de gènes ex vivo et de nouvelles thérapies in vivo ciblant leur différenciation. L’instrument central demandé dans notre pipeline est le système d’imagerie d’animaux vivants hautement sensible qui permettra de suivre les CS transplantées, les biomatériaux ainsi que les thérapies injectées in vivo dans nos modèles de rongeurs, ce qui jouera un rôle essentiel dans l’évaluation du succès / de la fin des essais précliniques. Cette analyse in vivo permettra de multiples mesures séquentielles chez le même animal, ce qui réduira considérablement les dépenses et les animaux utilisés, accélérant ainsi les projets de recherche et de découverte. De plus, l’équipement du pipeline utilisera la détection et l’imagerie par lumière proche infrarouge (near-infrared, NIR). La pénétration profonde de la lumière NIR (longueurs d’onde 600-1900 nm) diminue l’autofluorescence qui est courante aux longueurs d’onde visibles, et réduit la diffusion ce qui augmente la résolution et la sensibilité de détection. Tous les instruments de cette demande de subvention sont compatibles les uns avec les autres et rempliront un certain créneau dans la recherche sur les CS.
Notre objectif ultime est d’utiliser les ressources actuellement disponibles et, espérons-le, les ressources à venir, pour concevoir des stratégies qui peuvent améliorer notre connaissance des mécanismes qui dictent l’utilisation des CS dans la recherche préclinique et clinique. Nous espérons que ce pipeline d’infrastructure soutiendra également la création de projets translationnels novateurs au sein de notre communauté de recherche de McGill, dont le réseau de médecine régénérative de McGill (MRM), abritant de nouvelles collaborations visant les thérapies à base de CS et la modulation des CS de manière dans une approche du laboratoire à la clinique, au laboratoire.
Références
1. Atala, A., Lanza, R., Mikos, T. & Nerem, R. Principles of regenerative medicine. (Academic press, 2018).
2. Williams, L. A., Davis-Dusenbery, B. N. & Eggan, K. C. SnapShot: directed differentiation of pluripotent stem cells. Cell 149, 1174-1174. e1171 (2012).
3. Kimbrel, E. A. & Lanza, R. Next-generation stem cells—ushering in a new era of cell-based therapies. Nature Reviews Drug Discovery 19, 463-479 (2020).
4. Hass, R., Kasper, C., Böhm, S. & Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): a comparison of adult and neonatal tissue-derived MSC. Cell Communication and Signaling 9, 1-14 (2011).
5. Schwartz, S. D. et al. Embryonic stem cell trials for macular degeneration: a preliminary report. The Lancet 379, 713-720 (2012).
6. Mandai, M. et al. Autologous induced stem-cell–derived retinal cells for macular degeneration. New England Journal of Medicine 376, 1038-1046 (2017).
7. Clinical trials and drug safety, <https://www.canada.ca/en/health-canada/services/clinical-trials.html> (2022).
8. Clinical Research, <https://www.fda.gov/patients/drug-development-process/step-3-clinical-research> (2022).
9. Trounson, A., Thakar, R. G., Lomax, G. & Gibbons, D. Clinical trials for stem cell therapies. BMC medicine 9, 1-7 (2011).
10. Trounson, A. & McDonald, C. Stem cell therapies in clinical trials: progress and challenges. Cell stem cell 17, 11-22 (2015).
11. Martin, I., Galipeau, J., Kessler, C., Le Blanc, K. & Dazzi, F. Challenges for mesenchymal stromal cell therapies. Science translational medicine 11, eaat2189 (2019).
12. Sipp, D., Robey, P. G. & Turner, L. (Nature Publishing Group, 2018).
13. Dominici, M. et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy 8, 315-317 (2006).
14. Wilson, A. J., Rand, E., Webster, A. J. & Genever, P. G. Characterisation of mesenchymal stromal cells in clinical trial reports: analysis of published descriptors. Stem cell research & therapy 12, 1-15 (2021).
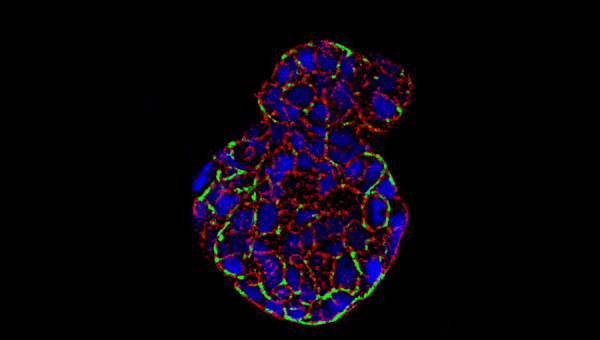
Crédit photo : Sphéroïde des glandes salivaires coloré avec de l’actine F (rouge), des zones de haute intensité (vert) et des noyaux (bleu), avec l’aimable autorisation de Jose Gil Munguia-Lopez et Sangeeth Pillai.
