MRM Insights : Polyphosphates inorganiques dans les applications de génie tissulaire du système musculo-squelettique

Dr Rahul Gawri
Chaque mois, dans les MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, Dr Rahul Gawri, Professeur adjoint au département de chirurgie de l’université McGill, nous parle des polyphosphates inorganiques et de leur potential dans les applications de genie tissulaire.
Polyphosphates inorganiques dans les applications de génie tissulaire du système musculo-squelettique : du fossile rémanent à la biomolécule fonctionnelle
Le système musculo-squelettique comprend les os, les muscles, le cartilage, les disques intervertébraux, les ligaments et les tendons et est dynamique dans sa fonction, sa physiologie et sa physiopathologie. Il est sujet à diverses offenses et blessures : traumatismes, dégénérescence liée à l’âge, lésions métaboliques, troubles auto-immuns, erreurs innées du métabolisme et troubles génétiques. Un large éventail de stratégies de génie tissulaire est actuellement utilisé et développé pour la régénération et la réparation des tissus musculo-squelettiques, y compris les implants, les facteurs de croissance, les thérapies cellulaires, les biomatériaux et les composés bioactifs innés. Toutes ces applications ont un succès limité et ont des effets secondaires connexes. Les composés bioactifs innés, une classe prometteuse de molécules bioactives, sont issus du corps et présumés générer des effets secondaires minimes et ont montré un potentiel énorme dans les applications de génie tissulaire et de médecine régénérative (TERM). Parmi ces composés bioactifs innés, on trouve les polyphosphates inorganiques (polyP).
L’avènement de la vie sur terre s’est déroulé dans des conditions extrêmes de pH très bas, de températures élevées, d’oxygène nul et d’un manque relatif de sucres simples [1-4]. Les océans de la planète étaient une « soupe » géante, chaude et frémissante, avec de nombreux composés organiques et inorganiques fabriqués [1, 5]. Beaucoup de ces nouvelles molécules ont agi comme les précurseurs des éléments constitutifs de la vie, tels que les acides aminés, les sucres complexes, les ribonucléotides et les ribonucléosides. L’une de ces molécules produites était le polyphosphate inorganique. Les polyphosphates inorganiques (polyP) ont été parmi les premières molécules à être fabriquées sur terre et ont jeté les bases de la vie telle que nous la connaissons [6, 7]. Ils ont servi de donneurs de groupe phosphate pour le métabolisme énergétique et on pense qu’ils sont les précurseurs de la structure sucre-phosphate de l’ADN simple brin et circulaire, et formant plus tard la double hélice complexe de l’ADN, en fournissant des groupes phosphate et en protégeant les structures ribonucléoside et ribonucléotide [8-11]. Jusqu’à récemment, les polyP étaient considérés comme des « molécules fossiles », qui sont un vestige du processus d’évolution [12], mais ils sont présents dans toutes les formes de vie sur cette planète, y compris les cellules de mammifères, et leur rôle dans la régulation des fonctions vitales critiques, y compris dans les cellules de mammifères, commence à être dévoilé doucement.
Les polyphosphates inorganiques (polyP) sont des polymères linéaires d’unités de phosphate répétées (PO4) liées par des liaisons phosphoanhydrures à haute énergie et dont la taille varie de quelques unités répétées à quelques milliers (2-10000s) [Figure 1] [13]. Le polyP semble avoir été une source d’énergie facile et riche depuis les temps prébiotiques jusqu’à aujourd’hui. Malheureusement, aucun minéral polyP abiotique ne peut être trouvé sur terre aujourd’hui [13, 14]. Commercialement, le polyP est produit en chauffant du phosphate inorganique dans des conditions anhydres [15]. Le polyP a d’abord été découvert sous forme de granules métachromatiques dans le cytoplasme de la bactérie Spirillum volutans, et il a donc été appelé « volutine ». Ces particules ont été colorées en rose par du bleu de toluidine basique et ont été retrouvées plus tard dans d’autres micro-organismes [16]. Les granules de polyP sont également présentes dans les cellules eucaryotes, mais sont appelées « acidocalcisomes ». [17]. Les principales enzymes impliquées dans le métabolisme du polyP sont la polyphosphate kinase (PPK, synthèse) [18] et l’exopolyphosphatase (PPX, dégradation) [19]. Les PPK se trouvent dans les bactéries, les champignons, les levures et les algues, mais restent indétectables dans les cellules de mammifères et de plantes à graines [20, 21]. On pense que la synthèse de polyP dans les cellules de mammifères et de plantes est liée à la respiration mitochondriale et implique la chaîne respiratoire et les interactions de la F0-F1-ATPase et du pore de transition de perméabilité mitochondriale (mPTP) [22, 23]. L’enzyme PPX n’a pas non plus été identifiée dans les cellules de mammifères, mais il a été démontré que la phosphatase alcaline clivait les unités orthophosphates de la chaîne polyphosphate, agissant ainsi comme enzyme catabolique [24, 25]. Seules trois enzymes métabolisant le polyP ont été identifiées chez l’homme. Il s’agit de la phosphatase alcaline (ALP) [25], de la protéine h-prune (un orthologue de l’exopolyphosphatase de levure PPX1), qui clive le groupe phosphate à l’extrémité d’une chaîne polyP [26], et de la diphosphoinositol polyphosphate phosphohydrolase (DIPP), une endopolyphosphatase qui coupe de longues chaînes polyP en chaînes plus courtes [27].
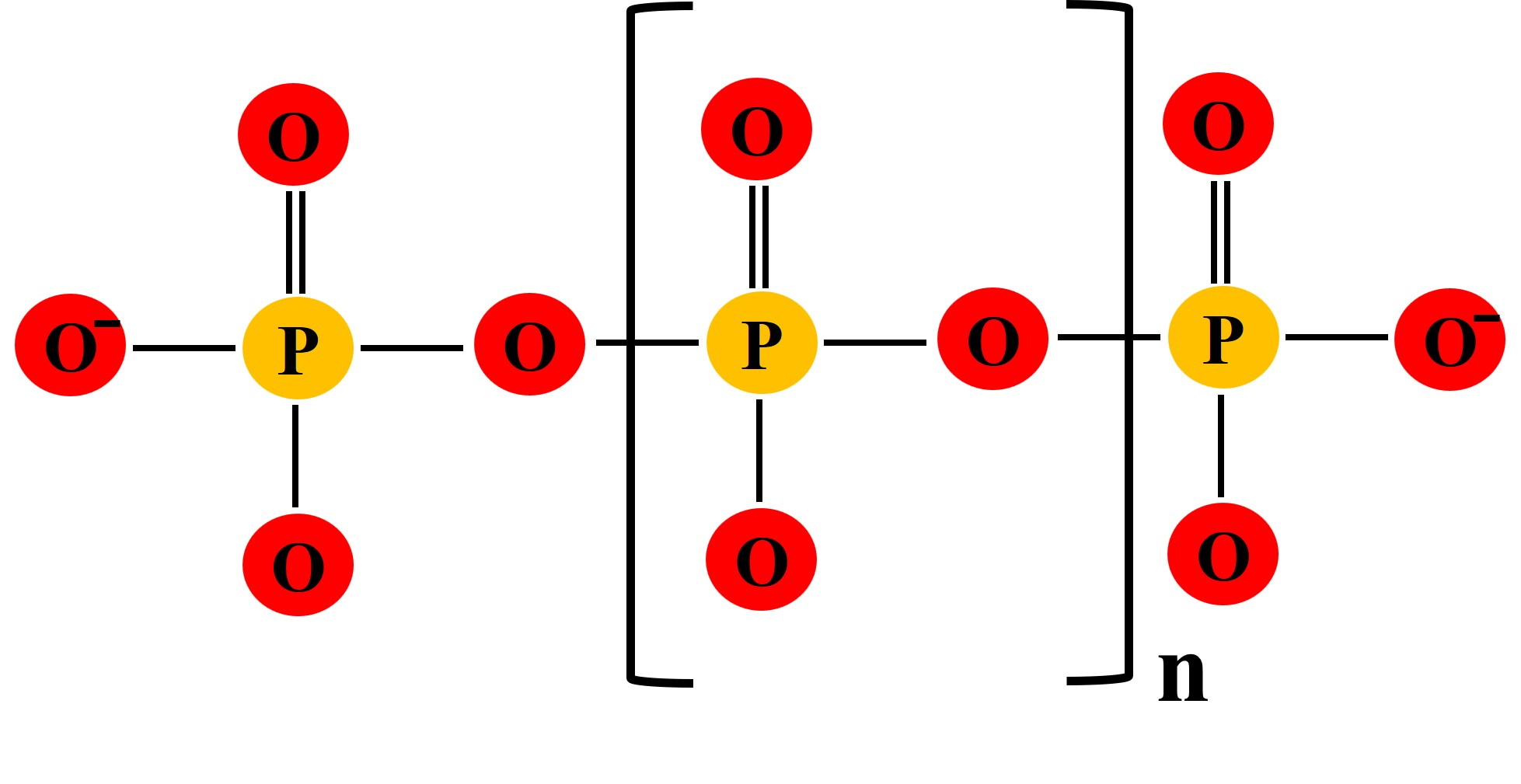
Figure 1 : Structure moléculaire des polyphosphates inorganiques linéaires polymères. n= nombre d’unités d’orthophosphate allant de quelques unités à quelques milliers. Figure adaptée d’Achbergerová et al. [13].
Dans le système mammifère, le polyP régule de nombreux processus physiologiques critiques en fonction de sa quantité et de la longueur de sa chaîne. Par exemple, le polyP régule la transmission neuronale, la coagulation du sang et la minéralisation [28-33]. Il a également été démontré que les polyPs modulent la fonction immunitaire en contrôlant étroitement la fonction des macrophages, des monocytes et des mastocytes [34-38]. Le polyP agit également comme une source d’énergie pour les cellules cancéreuses hautement actives, et l’épuisement du polyP entraîne une diminution de la migration cellulaire et des métastases [39] et améliore la radiosensibilité dans une cellule cancéreuse humaine dans le cancer du poumon dit « non à petites cellules » [40]. D’autre part, il a été démontré que le polyP régule la voie mTOR et la prolifération des cellules cancéreuses mammaires [41].
Dans les applications de génie tissulaire, le polyP a été utilisé dans différentes formulations, telles que le substrat biocéramique de polyphosphate de calcium (Ca-polyP) comme substitut osseux [42, 43] ou comme polyphosphate bioactif soluble [44-47]. Les applications de génie tissulaire et de la médecine régénérative (TERM) pour le polyP sont très diverses; avec utilisation dans l’ingénierie des tissus osseux [48-53], l’ingénierie du cartilage [46, 47, 54], la régénération du disque intervertébral [55, 56], le tissu vasculaire [57, 58], la modulation de la coagulation sanguine [59, 60] et la cicatrisation des plaies [61]. Les principales applications de génie tissulaire des différentes formulations de polyP sont résumées dans la Figure 2 [62].
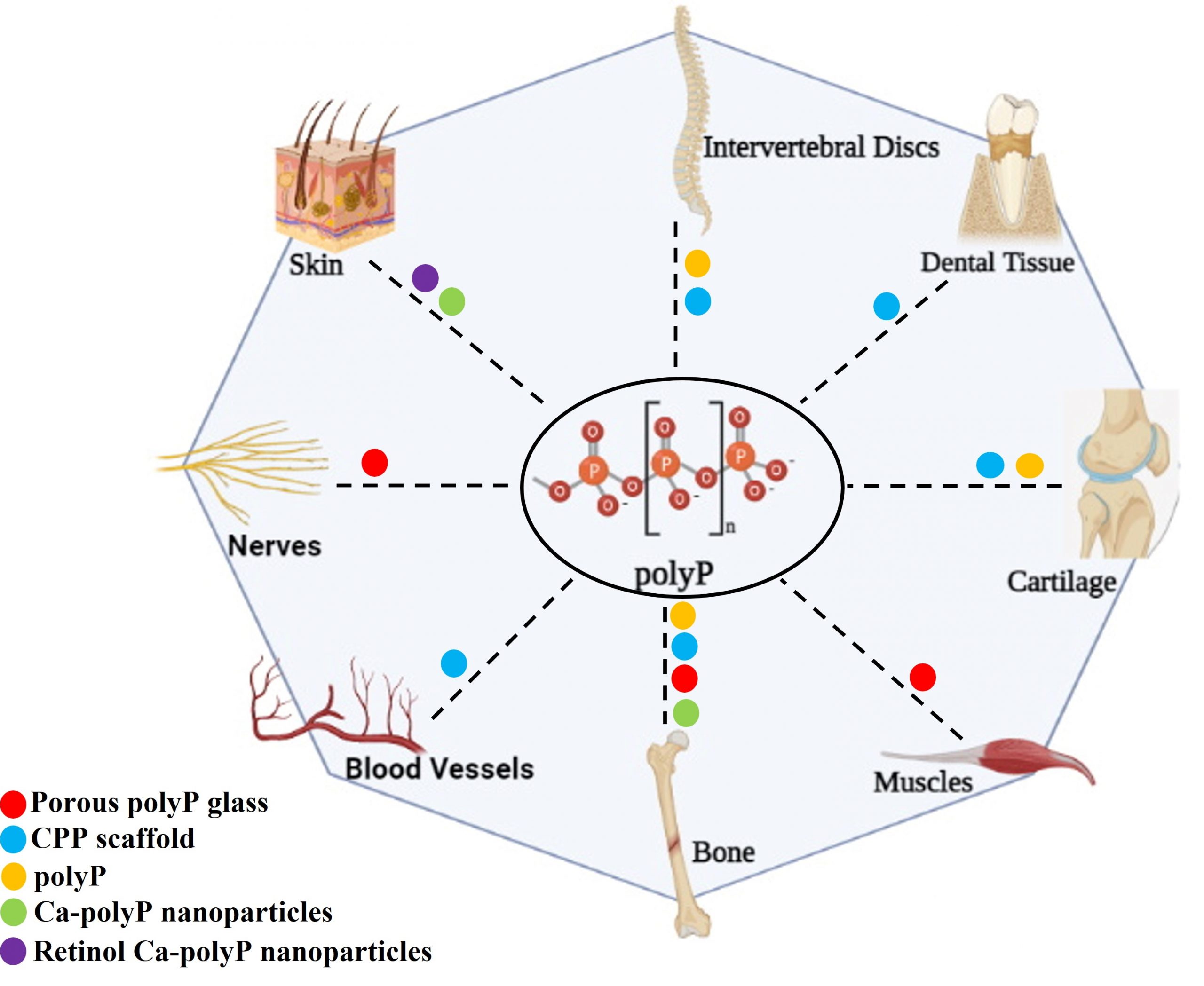
Figure 2 : Schéma représentant différentes formulations de polyP utilisées pour les applications de génie tissulaire et de médecine régénérative (TERM). Les points colorés indiquent l’utilisation des formulations spécifiques de polyP pour une application TERM particulière. Figure adaptée de Inorganic Polyphosphates in Eukaryotic Cells, 2016 (Gawri et al., Springer International Publishing) [62]. (Figure créée avec BioRender.com)
Le mécanisme d’action du polyP dépend du type cellulaire et de la longueur de sa chaîne. Pour les applications de génie tissulaire musculo-squelettique, le polyP synthétisé commercialement administré de manière exogène a déjà eu un effet anabolique maximal (accumulation de matrice extracellulaire) sur les cellules cartilagineuses avec une longueur de chaîne polyP-45 (45 unités orthophosphates) et pour une concentration de 1mM [47, 63]. En revanche, dans les cellules du disque intervertébral (noyau central pulpeux et cellules fibreuses annulaires périphériques), l’effet anabolisant maximal a été observé avec des polyP-22 et polyP-45 à une concentration de 1mM [55, 56]. Pour le développement ultérieur du polyP en tant qu’agent thérapeutique bioactif, le mécanisme d’action du polyP impliqué dans ces effets anabolisants doit être élucidé. Le mécanisme d’action du polyP est hautement spécifique au type cellulaire, par exemple en modulant la voie mTOR dans les cellules cancéreuses [41, 64], par l’activation du pore de transition de perméabilité mitochondriale (mPTP) [65-68], et la voie purinergique dans les cellules HUVEC et les neurones [69, 70]. Malgré les progrès réalisés dans le domaine du polyP, son mécanisme d’action dans les cellules du système musculo-squelettique n’a jamais été élucidé. Des travaux récents de Gawri et collaborateurs [44, 71] ont montré que le polyP provoque des flux de calcium, augmente les niveaux de calcium intracellulaire et active la voie PKC / Calmoduline / CREB / Sox9 dans les cellules cartilagineuses articulaires. Les canaux calciques voltage-dépendants médient partiellement cette entrée de calcium dans les cellules, et l’effet anabolisant est partiellement bloqué par des inhibiteurs de canaux spécifiques et un tampon de calcium intracellulaire BAPTA-AM. Le polyP suit le calcium entrant à l’intérieur des cellules vers ses emplacements de stockage intracellulaire et vers les mitochondries pour prévenir la mort cellulaire excessive médiée par le calcium. Il est ensuite transporté vers le noyau et module l’expression des gènes ; ainsi, le polyP a des fonctions multiformes dans les cellules cartilagineuses [44, 71].
En collaboration avec le Dr Xavier Banquy (Université de Montréal) et le Dr Paul Martineau (Université McGill), nous explorons actuellement le rôle du polyP dans la guérison des fractures et sa régulation du déplacement des cellules immunitaires vers le site de la fracture afin de développer des applications pour la réparation accélérée des fractures. Le PolyP est libéré au site de la fracture par dégranulation des plaquettes séquestrées à l’endroit de la blessure pour arrêter le saignement et maintenir l’homéostasie (caillot blanc). Ce polyP libéré peut agir comme un déclencheur antigénique de motif moléculaire associé aux dégâts (Damage-associated-molecular-pattern, DAMP) qui peut attirer plus de cellules immunitaires sur le site de la lésion osseuse et améliorer la réponse de réparation. De plus, nous avons montré que le polyP provoque des influx calciques dans les cellules RBL-2H3 (analogues des mastocytes), fournissant ainsi des preuves préliminaires que le polyP peut augmenter le calcium intracellulaire dans ces cellules et provoquer une dégranulation médiée par le calcium et la libération de facteurs de croissance pro-ostéogéniques. En outre, nous formulons des hydrogels thermosensibles intelligents libérant du polyP qui, implantés sur le site de fracture, libéreront du polyP en concentration et en longueur de chaîne spécifiques. Selon la conception de la formulation, nous visons qu’après la phase inflammatoire initiale de cicatrisation de la fracture (jours 1-5), le polyP dans l’hydrogel sera épuisé par clivage par unephosphatase alcaline non spécifique au tissu (Tissue-nonspecific alkaline phosphatase, TNAP), et l’hydrogel agira alors comme un échafaudage biologique pour que les cellules migrent et que la callosité de la fracture se développe et mûrisse en tissu osseux nouvellement établi et se remodèle. Ce repérage dirigé des cellules immunitaires sur le site de la fracture vise à induire une réponse accélérée de guérison de la fracture.
En conclusion, le polyP est une classe passionnante de molécules bioactives avec un immense potentiel d’utilisation dans les applications de génie tissulaire. Bien que prometteuse, l’utilisation du polyP doit encore être affinée en raison des rôles et des fonctions multiformes qu’il peut exercer sur différents types de cellules.
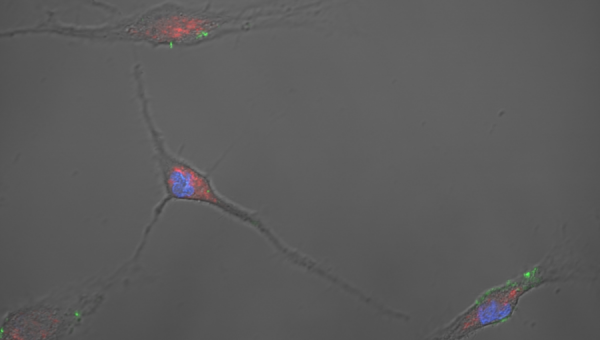
Image illustrative : Image confocale d’ostéoblastes murins primaires montrant du polyphosphate inorganique (vert, décalage de fluorescence DAPI) se localisant avec des mitochondries (rouge, MitoTracker Dye) et centré autour du noyau (bleu, DAPI). Avec l’aimable autorisation du Laboratoire d’orthopédie régénérative et d’innovation (Chercheur principal : Gawri).
Références
1. Kasting, J.F. and M.T. Howard, Atmospheric composition and climate on the early earth. Philos Trans R Soc Lond B Biol Sci, 2006. 361(1474): p. 1733-41; discussion 1741-2.
2. Kasting, J.F. and T.P. Ackerman, Climatic consequences of very high carbon dioxide levels in the earth’s early atmosphere. Science, 1986. 234: p. 1383-5.
3. Kasting, J.F., Earth’s early atmosphere. Science, 1993. 259(5097): p. 920-6.
4. Catling, D.C., Comment on « A hydrogen-rich early Earth atmosphere ». Science, 2006. 311(5757): p. 38; author reply 38.
5. Bischoff, J.L. and R.J. Rosenbauer, The critical point and two-phase boundary of seawater, 200–500°C. Earth and Planetary Science Letters, 1984. 68(1): p. 172-180.
6. Kauffman, S.A., Approaches to the origin of life on earth. Life (Basel), 2011. 1(1): p. 34-48.
7. Yamagata, Y., et al., Volcanic production of polyphosphates and its relevance to prebiotic evolution. Nature, 1991. 352(6335): p. 516-519.
8. Hulshof, J. and C. Ponnamperuma, Prebiotic condensation reactions in an aqueous medium: A review of condensing agents. Origins of life, 1976. 7(3): p. 197-224.
9. Lohrmann, R. and L.E. Orgel, Prebiotic synthesis: phosphorylation in aqueous solution. Science, 1968. 161(3836): p. 64-6.
10. Rabinowitz, J., S. Chang, and C. Ponnamperuma, Phosphorylation on the Primitive Earth: Phosphorylation by way of Inorganic Phosphate as a Potential Prebiotic Process. Nature, 1968. 218(5140): p. 442-443.
11. Schwartz, A. and S.W. Fox, Thermal synthesis of internucleotide phosphodiester linkages. Biochimica et Biophysica Acta (BBA) – Specialized Section on Nucleic Acids and Related Subjects, 1964. 87(4): p. 694-696.
12. Brown, M.R. and A. Kornberg, Inorganic polyphosphate in the origin and survival of species. Proc Natl Acad Sci U S A, 2004. 101(46): p. 16085-7.
13. Achbergerová, L. and J. Nahálka, Polyphosphate – an ancient energy source and active metabolic regulator. Microbial Cell Factories, 2011. 10(1): p. 63.
14. Achbergerová, L. and J. Nahálka, Polyphosphate–an ancient energy source and active metabolic regulator. Microb Cell Fact, 2011. 10: p. 63.
15. Baltscheffsky, H., et al., On the origin and evolution of life: an introduction. J Theor Biol, 1997. 187(4): p. 453-9.
16. Meyer, A., Orientirende untersuchungen über verbreitung, morphologie und chemie des volutins. 1904: A. Felix.
17. Docampo, R., P. Ulrich, and S.N. Moreno, Evolution of acidocalcisomes and their role in polyphosphate storage and osmoregulation in eukaryotic microbes. Philos Trans R Soc Lond B Biol Sci, 2010. 365(1541): p. 775-84.
18. Kornberg, A., S.R. Kornberg, and E.S. Simms, Metaphosphate synthesis by an enzyme from Escherichia coli. Biochim Biophys Acta, 1956. 20(1): p. 215-27.
19. Akiyama, M., E. Crooke, and A. Kornberg, An exopolyphosphatase of Escherichia coli. The enzyme and its ppx gene in a polyphosphate operon. J Biol Chem, 1993. 268(1): p. 633-9.
20. Pavlov, E., et al., Inorganic polyphosphate and energy metabolism in mammalian cells. J Biol Chem, 2010. 285(13): p. 9420-9428.
21. Hooley, P., M.P. Whitehead, and M.R. Brown, Eukaryote polyphosphate kinases: is the ‘Kornberg’ complex ubiquitous? Trends Biochem Sci, 2008. 33(12): p. 577-82.
22. Pavlov, E., et al., A large, voltage-dependent channel, isolated from mitochondria by water-free chloroform extraction. Biophys J, 2005. 88(4): p. 2614-25.
23. Abramov, A.Y., et al., Targeted polyphosphatase expression alters mitochondrial metabolism and inhibits calcium-dependent cell death. Proc Natl Acad Sci U S A, 2007. 104(46): p. 18091-6.
24. Omelon, S., et al., Colocation and role of polyphosphates and alkaline phosphatase in apatite biomineralization of elasmobranch tesserae. Acta Biomaterialia, 2014. 10(9): p. 3899-3910.
25. Mikami, Y., et al., Alkaline phosphatase determines polyphosphate-induced mineralization in a cell-type independent manner. J Bone Miner Metab, 2016. 34(6): p. 627-637.
26. Tammenkoski, M., et al., Human metastasis regulator protein H-prune is a short-chain exopolyphosphatase. Biochemistry, 2008. 47(36): p. 9707-13.
27. Lonetti, A., et al., Identification of an evolutionarily conserved family of inorganic polyphosphate endopolyphosphatases. J Biol Chem, 2011. 286(37): p. 31966-74.
28. Brown, M.R. and A. Kornberg, Inorganic polyphosphate in the origin and survival of species. Proceedings of the National Academy of Sciences, 2004. 101(46): p. 16085-16087.
29. Fleish, H. and W.F. Neuman, Mechanisms of calcification: role of collagen, polyphosphates, and phosphatase. American Journal of Physiology-Legacy Content, 1961. 200(6): p. 1296-1300.
30. Rashid, M.H., N.N. Rao, and A. Kornberg, Inorganic polyphosphate is required for motility of bacterial pathogens. Journal of bacteriology, 2000. 182(1): p. 225-227.
31. Morrissey, J. and S. Smith, Polyphosphate as modulator of hemostasis, thrombosis, and inflammation. Journal of Thrombosis and Haemostasis, 2015. 13: p. S92-S97.
32. Holmström, K.M., et al., Signalling properties of inorganic polyphosphate in the mammalian brain. Nature Communications, 2013. 4(1): p. 1362.
33. Kumble, K.D. and A. Kornberg, Inorganic polyphosphate in mammalian cells and tissues. J Biol Chem, 1995. 270(11): p. 5818-22.
34. Bae, J.S., W. Lee, and A.R. Rezaie, Polyphosphate elicits pro-inflammatory responses that are counteracted by activated protein C in both cellular and animal models. Journal of thrombosis and haemostasis : JTH, 2012. 10(6): p. 1145-1151.
35. Mailer, R.K.W., et al., Polyphosphate as a Target for Interference With Inflammation and Thrombosis. Frontiers in Medicine, 2019. 6(76).
36. Moreno, S.N.J. and R. Docampo, Polyphosphate and Its Diverse Functions in Host Cells and Pathogens. PLOS Pathogens, 2013. 9(5): p. e1003230.
37. Kim, W., et al., Inositol polyphosphates promote T cell-independent humoral immunity via the regulation of Bruton’s tyrosine kinase. Proceedings of the National Academy of Sciences, 2019. 116(26): p. 12952-12957.
38. Ito, T., et al., Inorganic polyphosphate potentiates lipopolysaccharide-induced macrophage inflammatory response. Journal of Biological Chemistry, 2020. 295(12): p. 4014-4023.
39. Kulakovskaya, E.V., M.Y. Zemskova, and T.V. Kulakovskaya, Inorganic Polyphosphate and Cancer. Biochemistry (Moscow), 2018. 83(8): p. 961-968.
40. Tsutsumi, K., et al., Inorganic polyphosphate enhances radio-sensitivity in a human non–small cell lung cancer cell line, H1299. Tumor Biology, 2017. 39(6): p. 1010428317705033.
41. Wang, L., et al., Inorganic polyphosphate stimulates mammalian TOR, a kinase involved in the proliferation of mammary cancer cells. Proceedings of the National Academy of Sciences, 2003. 100(20): p. 11249-11254.
42. Gu, Z., et al., Cell-mediated degradation of strontium-doped calcium polyphosphate scaffold for bone tissue engineering. Biomed Mater, 2012. 7(6): p. 065007.
43. Grynpas, M.D., et al., Porous calcium polyphosphate scaffolds for bone substitute applications in vivo studies. Biomaterials, 2002. 23(9): p. 2063-70.
44. Gawri, R., et al., The anabolic effect of inorganic polyphosphate on chondrocytes is mediated by calcium signalling. J Orthop Res, 2021.
45. Gawri, R., et al., Inorganic polyphosphates enhances nucleus pulposus tissue formation in vitro. J Orthop Res, 2017. 35(1): p. 41-50.
46. St-Pierre, J.P., et al., Calcification of cartilage formed in vitro on calcium polyphosphate bone substitutes is regulated by inorganic polyphosphate. Acta Biomater, 2010. 6(8): p. 3302-9.
47. St-Pierre, J.P., et al., Inorganic polyphosphate stimulates cartilage tissue formation. Tissue Eng Part A, 2012. 18(11-12): p. 1282-92.
48. Cooke, M.E., et al., 3D Printed Polyurethane Scaffolds for the Repair of Bone Defects. Frontiers in bioengineering and biotechnology, 2020. 8: p. 557215-557215.
49. Levengood, S.K.L. and M. Zhang, Chitosan-based scaffolds for bone tissue engineering. Journal of Materials Chemistry B, 2014. 2(21): p. 3161-3184.
50. Yoshikawa, H. and A. Myoui, Bone tissue engineering with porous hydroxyapatite ceramics. J Artif Organs, 2005. 8(3): p. 131-6.
51. Müller, W.E.G., et al., Fabrication of a new physiological macroporous hybrid biomaterial/bioscaffold material based on polyphosphate and collagen by freeze-extraction. Journal of Materials Chemistry B, 2017. 5(21): p. 3823-3835.
52. Zong, C., et al., Biocompatibility and bone-repairing effects: comparison between porous poly-lactic-co-glycolic acid and nano-hydroxyapatite/poly(lactic acid) scaffolds. J Biomed Nanotechnol, 2014. 10(6): p. 1091-104.
53. Zhao, D., et al., Poly(lactic-co-glycolic acid)-based composite bone-substitute materials. Bioactive materials, 2020. 6(2): p. 346-360.
54. Kandel, R.A., et al., repair of osteochondral defects with biphasic cartilage-calcium polyphosphate constructs in a sheep model. Biomaterials, 2006. 27(22): p. 4120-31.
55. Wang, X., et al., Inorganic polyphosphates stimulates matrix production in human annulus fibrosus cells. JOR Spine, 2021. 4(2): p. e1143.
56. Gawri, R., et al., Inorganic polyphosphates enhances nucleus pulposus tissue formation in vitro. J Orthop Res, 2016.
57. L’Heureux, N., et al., Technology Insight: the evolution of tissue-engineered vascular grafts—from research to clinical practice. Nature Clinical Practice Cardiovascular Medicine, 2007. 4(7): p. 389-395.
58. Neufurth, M., et al., Engineering a morphogenetically active hydrogel for bioprinting of bioartificial tissue derived from human osteoblast-like SaOS-2 cells. Biomaterials, 2014. 35(31): p. 8810-8819.
59. Donovan, A.J., et al., Size-Controlled Synthesis of Granular Polyphosphate Nanoparticles at Physiologic Salt Concentrations for Blood Clotting. Biomacromolecules, 2014. 15(11): p. 3976-3984.
60. Szymusiak, M., et al., Colloidal Confinement of Polyphosphate on Gold Nanoparticles Robustly Activates the Contact Pathway of Blood Coagulation. Bioconjugate Chemistry, 2016. 27(1): p. 102-109.
61. Müller, W.E.G., et al., Electrospun bioactive mats enriched with Ca-polyphosphate/retinol nanospheres as potential wound dressing. Biochem Biophys Rep, 2015. 3: p. 150-160.
62. Gawri, R., et al., Inorganic Polyphosphate in Tissue Engineering, in Inorganic Polyphosphates in Eukaryotic Cells, T. Kulakovskaya, E. Pavlov, and E.N. Dedkova, Editors. 2016, Springer International Publishing: Cham. p. 217-239.
63. St-Pierre, J.P., et al., The incorporation of a zone of calcified cartilage improves the interfacial shear strength between in vitro-formed cartilage and the underlying substrate. Acta Biomater, 2012. 8(4): p. 1603-15.
64. Wang, L., et al., Inorganic polyphosphate stimulates mammalian TOR, a kinase involved in the proliferation of mammary cancer cells. Proc Natl Acad Sci U S A, 2003. 100(20): p. 11249-54.
65. Solesio, M.E., et al., Inorganic polyphosphate (polyP) as an activator and structural component of the mitochondrial permeability transition pore. Biochem Soc Trans, 2016. 44(1): p. 7-12.
66. Seidlmayer, L.K., et al., Inorganic polyphosphate is a potent activator of the mitochondrial permeability transition pore in cardiac myocytes. J Gen Physiol, 2012. 139(5): p. 321-31.
67. Elustondo, P.A., et al., Mitochondrial permeability transition pore induction is linked to formation of the complex of ATPase C-subunit, polyhydroxybutyrate and inorganic polyphosphate. Cell Death Discovery, 2016. 2(1): p. 16070.
68. Seidlmayer, L.K., et al., Distinct mPTP activation mechanisms in ischaemia–reperfusion: contributions of Ca2+, ROS, pH, and inorganic polyphosphate. Cardiovascular Research, 2015. 106(2): p. 237-248.
69. Holmstrom, K.M., et al., Signalling properties of inorganic polyphosphate in the mammalian brain. Nat Commun, 2013. 4: p. 1362.
70. Dinarvand, P., et al., polyphosphate amplifies proinflammatory responses of nuclear proteins through interaction with receptor for advanced glycation end products and P2Y1 purinergic receptor. Blood, 2014. 123(6): p. 935-45.
71. Gawri, R.K., Uros, et al., Phosphoproteomic analysis of chondrocytes after short-term exposure to inorganic polyphosphate. bioRxiv, 2021: p. 2021.07.30.454470.
