MRM Insights : Régénérer le microenvironnement natif avec la matrice extracellulaire décellularisée

Nicole Li-Jessen

Mika Brown
Chaque mois, dans les MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, Mika Brown, candidate au doctorat au Département de génie biologique et biomédical, et sa superviseure Nicole Li-Jessen, Professeure agrégée dans l’École des Sciences de la communication humaine, discutent de comment régénérer le microenvironnement natif avec la matrice extracellulaire décellularisée.
Régénérer le microenvironnement natif avec la matrice extracellulaire décellularisée – Vers des traitements durables
La matrice extracellulaire décellularisée (dMEC) est un biomatériau naturel dérivé de tissus humains ou animaux en éliminant les cellules et les antigènes acellulaires. [1] Un grand avantage de la dMEC est qu’elle fournit un environnement naturel que les cellules connaissent déjà et dans lequel elles peuvent fonctionner efficacement. Les matériaux dMEC ont montré un excellent potentiel de régénération en minimisant la réponse des corps étrangers, en stimulant la vascularisation et en favorisant le remodelage de la MEC. [2] Essentiellement, la dMEC contient des protéines structurelles (comme par exemple du collagène et de l’élastine), des macromolécules (comme des protéoglycanes et des glycosaminoglycanes) qui jouent un rôle complexe dans l’homéostasie et la réparation des tissus. [1] Les petites molécules liées à la matrice telles que les facteurs de croissance et les particules comme les vésicules extracellulaires peuvent également être conservées après la décellularisation. [1, 3] Les facteurs de croissance stimulent les processus de régénération, y compris l’angiogenèse, tandis que les vésicules extracellulaires contribuent à la modulation des cellules immunitaires et à l’homéostasie. Grâce à sa structure et sa composition complexes, la dMEC a une capacité unique à stimuler les processus natifs de cicatrisation des plaies allant du recrutement cellulaire, de la différenciation des cellules souches, de la modulation immunitaire à la production de néo-MEC.
État actuel de la recherche sur les biomatériaux dECM
Dans le passé, les biomatériaux dMEC étaient principalement fabriqués sous forme d’organes ou de feuilles décellularisés entiers. [1, 4] Ces biomatériaux dMEC pouvaient être recellularisés pour des applications prévues dans des transplantations pulmonaires ou aortiques ou, avec plus de succès, utilisés comme greffes de tissus mous acellulaires. Cependant, les propriétés physico-chimiques des biomatériaux dMEC entiers sont affectées par le processus de décellularisation, ce qui entraîne des changements structurels et mécaniques, des interactions cellule-matrice inefficaces et des résultats sous-optimaux. [5, 6]
La recherche actuelle sur les biomatériaux dECM a évolué vers des biomatériaux construits à partir de dMEC broyées en petites particules, solubilisées avec des enzymes et reconstituées sous différentes formes telles que les hydrogels.
Nous avons récemment publié un article de revue complet sur les tendances actuelles des biomatériaux régénératifs dMEC. [1] Dans notre revue, les biomatériaux à base de particules de dMEC ont connu une croissance exponentielle au cours de la dernière décennie (2012 – 2021), passant de seulement 7 articles d’archives dans 5 types de tissus à 93 articles sur 19 types de tissus. Les types de biomatériaux dMEC se sont également étendus des hydrogels injectables, des échafaudages moulés et des échafaudages électrofilés pour inclure des échafaudages bioimprimés et des nanoparticules aérosolisées. Dans cet article, nous nous concentrons sur les hydrogels injectables, les échafaudages électrofilés et les échafaudages bioimprimés avec quelques exemples classiques (Figure 1).
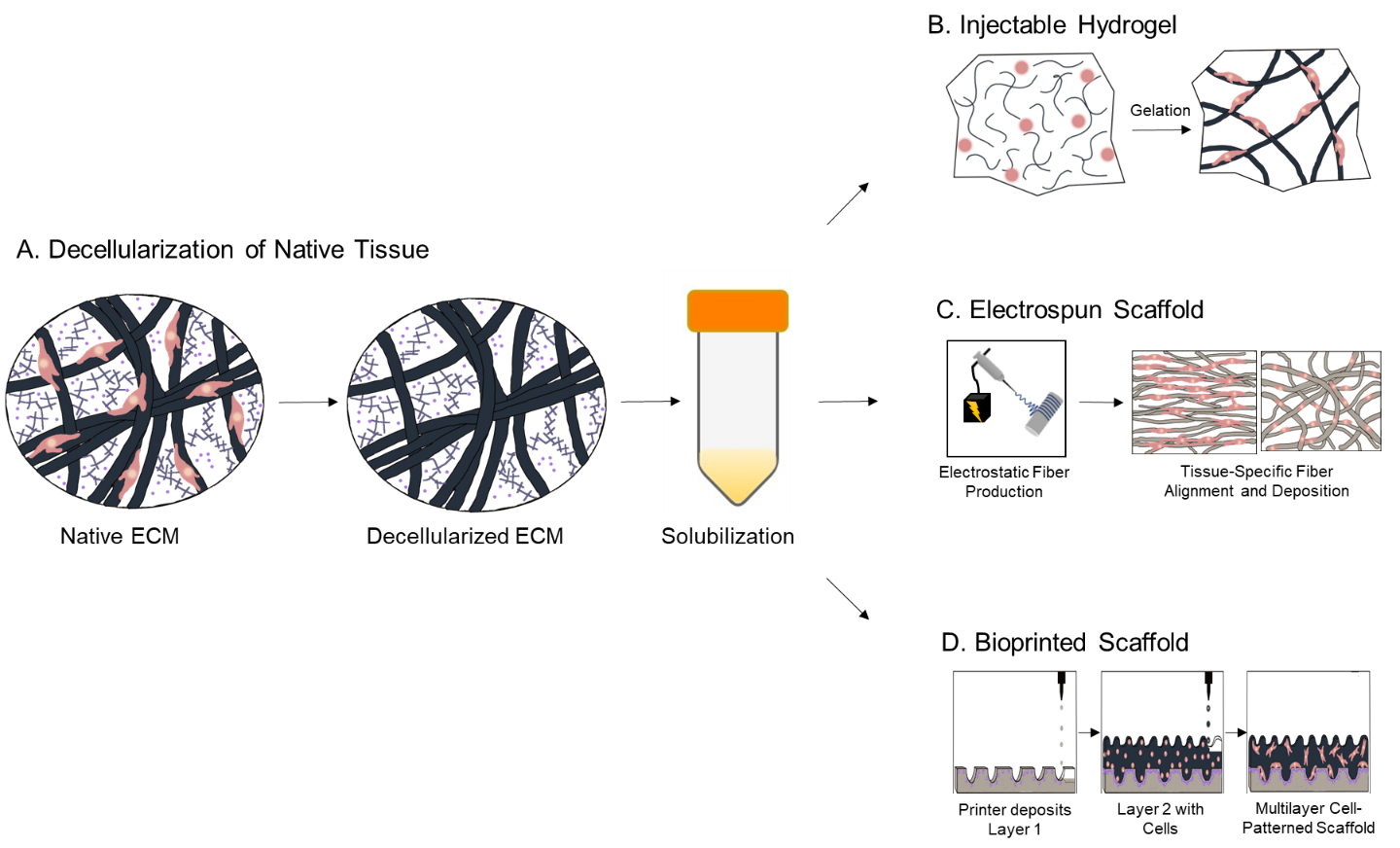
Figure 1. Décellularisation et fabrication de trois candidats prometteurs pour les biomatériaux à base de particules dMEC. A. Décellularisation et solubilisation de la dMEC. B. Formation d’hydrogels injectables. C. Dépôt de fibres dans des échafaudages électrofilés. D. Modelage d’échafaudages bioimprimés multicouches chargés de cellules. [1]
Principaux types de biomatériaux dMEC
Les hydrogels injectables dMEC sont préparés en solubilisant des particules de dMEC, après quoi un hydrogel se forme lorsqu’il est incubé à 37 ° C, ou température physiologique. [1] Les hydrogels sont le biomatériau dMEC le plus courant car ils peuvent être injectés pour combler complètement les défauts et ont de faibles coûts de main-d’œuvre et de production pour une expansion. Un hydrogel dMEC récent notable a été préparé par réticulation de la dMEC pulmonaire avec du polyéthylène glycol (PEG) photopolymérisable en utilisant la chimie du thiol-ene click. [7] Dans cette étude, la photopolymérisation a été réalisée après ensemencement avec des fibroblastes pour induire une rigidification des hydrogels à se rigidifier, passant d’un module élastique caractéristique d’un poumon sain à celui d’un poumon fibrotique. Les chercheurs ont étudié comment l’environnement ainsi rigidifié affectait la production de protéines fibrotiques : le collagène 1A1 et l’α-actine du muscle lisse par les fibroblastes pulmonaires. Au jour 7, l’expression des deux protéines fibrotiques était jusqu’à 3 fois plus élevée que les témoins d’hydrogel non renforcés.
Les échafaudages électrofilés sont préparés en étirant des microfibres à travers une aiguille métallique contenant une solution de dMEC solubilisée par haute tension. [1] Les microfibres sont déposées sur un collecteur et stratifiées pour produire un échafaudage. Les échafaudages électrofilés ont la capacité d’imiter l’architecture des tissus en créant un motif de fibres qui peut être adapté à des applications spécifiques, telles qu’une distribution radiale concentrique pour la réparation de la cornée, une membrane de filtration rénale pour les reins ou un pont en forme de tube pour la régénération axonale. [8-10] Dans une étude de dMEC cornéenne, la distribution radiale des fibres de dMEC-polycaprolactone (PCL) a aidé les kératinocytes stromaux cornéens à faire le pont entre les fibres et à adopter leur morphologie native contrairement à un échafaudage avec des fibres alignées aléatoirement. [8]
La bioencre dMEC est imprimée en suivant un motif goutte à goutte pour reproduire les dimensions et la structure d’un défaut, d’un tissu ou d’un organe, formant un échafaudage bioimprimé. [1] La bio-impression est prometteuse pour la réplication de structures avec une architecture tissulaire complexe ou stratifiée, et des propriétés mécaniques locorégionales variées. Les cellules peuvent être imprimées avec une bio-encre dans des régions spécifiques de l’échafaudage pour aider au développement de structures complexes, telles que les voies biliaires chargées de cholangiocytes dans le foie. [11] Par exemple, un cadre de PCL cylindrique « ridé » contenant des couches bioimprimées de dMEC musculaire œsophagienne avec des cellules musculaires lisses et de dMEC muqueuse avec des cellules épithéliales œsophagiennes a été conçu pour imiter un segment de l’œsophage. [12] Par rapport à un contrôle I-PCL de collagène, les échafaudages dMEC-PCL présentaient une expression significativement plus élevée de l’α-actine musculaire lisse par les cellules musculaires lisses et de l’E-cadhérine par les cellules épithéliales.
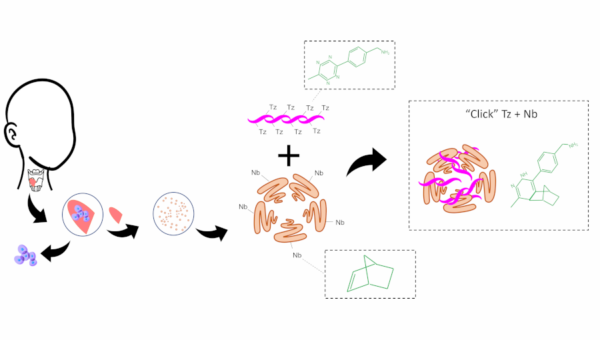
Les hydrogels dMEC Click pour la régénération permanente des cordes vocales
La majorité des matériaux dMEC abordés dans cet article sont des composites réticulés. La réticulation et les composites peuvent tous deux aider à augmenter les propriétés mécaniques et la stabilité des matériaux naturels et à réduire la contraction de l’échafaudage par les cellules. Par exemple, les échafaudages dMEC-PEG et dMEC-PCL précédemment discutés ont démontré des propriétés mécaniques égales ou supérieures au tissu cible sain. [7, 8, 12] Il a été démontré que les échafaudages de collagène résistent à la contraction en culture cellulaire en utilisant des méthodes de réticulation telles que la méthacrylation et le glutéraldéhyde. [13, 14] Les échafaudages dMEC peuvent également souffrir de contraction en culture cellulaire. [15] La réticulation par clic avec des polymères naturels (comme l’alginate ou le chitosane) produit des matériaux composites sans produits secondaires toxiques qui restent biodégradables, mais avec des taux de dégradation ralentis qui favorisent mieux la régénération. [16]
Mon projet au Laboratoire de la voix et des voies respiratoires supérieures de la professeure Nicole Li-Jessen à McGill porte sur le développement de biomatériaux dMEC pour la réparation des défauts des tissus mous, en particulier les cordes vocales dans le larynx. Les cordes vocales humaines adultes sont des organes particulièrement petits avec des dimensions de 10 à 20 mm de longueur longitudinale, de 8 à 12 mm de longueur transversale et de 3 à 10 mm d’épaisseur. [17] Les hydrogels injectables sont idéaux pour le traitement des défauts des cordes vocales, car ils peuvent être appliqués à l’aide de procédures minimalement invasives. Cependant, les cordes vocales injectables actuelles nécessitent une réinjection périodique et ne fournissent pas de solutions permanentes pour la régénération tissulaire.

Figure 2. Contraction des hydrogels dMEC Click-alginate et dMEC seul sur 14 jours.. Les hydrogels dMEC Click-alginate résistent à la contraction tandis que les hydrogels dMEC seuls ont montré jusqu’à 90% de contraction.
L’une des tendances actuelles dans les biomatériaux dMEC est d’utiliser les matériaux dérivés du tissu cible, étant donné que la composition de la MEC diffère d’un tissu à l’autre et contient des indices spécifiques aux tissus. [1, 18] Cependant, la petite taille de la corde vocale présente un défi pour la mise à l’échelle de la dMEC des cordes vocales. J’ai terminé une étude protéomique comparant la dMEC de la corde vocale porcine à la sous-muqueuse de l’intestin grêle porcine (small intestinal submucosa, SIS) disponible dans le commerce afin de déterminer si une autre source de tissus mous peut être utilisée dans les applications de cordes vocales. La dMEC-SIS répond au défi de fabrication de l’approvisionnement et de l’accessibilité, tandis que la dMEC des cordes vocales contient des molécules bioactives spécifiques aux tissus cibles. Nous avons constaté que la dMEC des cordes vocales possède une plus grande similitude avec la corde vocale native que la dMEC-SIS, ce qui indique des effets spécifiques aux tissus. Cependant, la dMEC-SIS a stimulé la production de composants clés de la MEC des cordes vocales, l’élastine et l’HA, à des niveaux comparables à ceux des dMEC des cordes vocales avec moins de variations au sein du groupe. Ces résultats ont indiqué que la dMEC-SIS pourrait s’avérer une alternative viable et évolutive à la dMEC vocale spécifique aux tissus.
De plus, pour pallier le besoin de réinjection dû à la dégradation rapide des biomatériaux, je développe un hydrogel injectable produit à partir de dMEC Click et d’alginate. Les cordes vocales et la dMEC-SIS sont utilisées dans cette étude. Les deux hydrogels dMEC Click-alginate possèdent une plus grande stabilité mécanique et structurelle que les hydrogels dMEC seuls. Par exemple, le module de Young des hydrogels d’alginate dMEC Click (0,5-3 kPa) se situe dans la plage des cordes vocales natives (0,5-13 kPa),[19] et significativement supérieur à celui des hydrogels dMEC seuls (0,015-0,06 kPa). Alors que les hydrogels contenant uniquement des dMEC présentent jusqu’à 90 % de contraction sur 14 jours, il a été démontré que les hydrogels dMEC Click-alginate résistent à la contraction des cultures de fibroblastes des cordes vocales humaines (Figure 2). Nos travaux en cours apportent un biomatériau injectable naturel plus stable et évolutif au domaine de l’ingénierie tissulaire des cordes vocales, présentant une option pour la régénération permanente des cordes vocales.
Références
[1] M. Brown, J. Li, C. Moraes, M. Tabrizian, N.Y.K. Li-Jessen, Decellularized extracellular matrix: New promising and challenging biomaterials for regenerative medicine, Biomaterials 289 (2022) 121786.
[2] P.T. Coburn, X. Li, J. Li, Y. Kishimoto, N.Y. Li-Jessen, Progress in Vocal Fold Regenerative Biomaterials: An Immunological Perspective, Advanced NanoBiomed Research (2021) 2100119.
[3] L. Huleihel, G.S. Hussey, J.D. Naranjo, L. Zhang, J.L. Dziki, N.J. Turner, D.B. Stolz, S.F. Badylak, Matrix-bound nanovesicles within ECM bioscaffolds, J Science advances 2(6) (2016) e1600502.
[4] S.F. Badylak, P.V. Kochupura, I.S. Cohen, S.V. Doronin, A.E. Saltman, T.W. Gilbert, D.J. Kelly, R.A. Ignotz, G.R. Gaudette, The use of extracellular matrix as an inductive scaffold for the partial replacement of functional myocardium, Cell Transplantation 15(1_suppl) (2006) 29-40.
[5] L.T. Saldin, M.C. Cramer, S.S. Velankar, L.J. White, S.F. Badylak, Extracellular matrix hydrogels from decellularized tissues: Structure and function, Acta Biomaterialia 49 (2017) 1-15.
[6] T.J. Keane, I.T. Swinehart, S.F. Badylak, Methods of Tissue Decellularization Used for Preparation of Biologic Scaffolds and In Vivo Relevance, Methods 84 (2015) 25-34.
[7] C.L. Petrou, T.J. D’Ovidio, D.A. Bölükbas, S. Tas, R.D. Brown, A. Allawzi, S. Lindstedt, E. Nozik-Grayck, K.R. Stenmark, D.E. Wagner, Clickable Decellularized Extracellular Matrix as a New Tool for Building Hybrid-Hydrogels to Model Chronic Fibrotic Diseases In Vitro, Journal of Materials Chemistry B 8(31) (2020) 6814-6826.
[8] J. Fernández-Pérez, K.E. Kador, A.P. Lynch, M. Ahearne, Characterization of extracellular matrix modified poly(ε-caprolactone) electrospun scaffolds with differing fiber orientations for corneal stroma regeneration, Materials Science and Engineering C 108 (2020) 110415.
[9] S. Chen, Z. Du, J. Zou, S. Qiu, Z. Rao, S. Liu, X. Sun, Y. Xu, Q. Zhu, X. Liu, H.Q. Mao, Y. Bai, D. Quan, Promoting Neurite Growth and Schwann Cell Migration by the Harnessing Decellularized Nerve Matrix onto Nanofibrous Guidance, ACS Applied Material Interfaces 11(19) (2019) 17167-17176.
[10] R. Sobreiro-Almeida, D.R. Fonseca, N.M. Neves, Extracellular matrix electrospun membranes for mimicking natural renal filtration barriers, Materials Science and Engineering C Materials Biological Applications 103 (2019) 109866.
[11] P.L. Lewis, J. Su, M. Yan, F.Y. Meng, S.S. Glaser, G.D. Alpini, R.M. Green, B. Sosa-Pineda, R.N. Shah, Complex bile duct network formation within liver decellularized extracellular matrix hydrogels, Scientific Reports 8(1) (2018) 1-14.
[12] H. Nam, H.-J. Jeong, Y. Jo, J.Y. Lee, D.-H. Ha, J.H. Kim, J.H. Chung, Y.-S. Cho, D.-W. Cho, S.-J. Lee, J. Jang, Multi-layered Free-form 3D Cell-printed Tubular Construct with Decellularized Inner and Outer Esophageal Tissue-derived Bioinks, Scientific Reports 10(1) (2020) 7255.
[13] C. Lotz, F.F. Schmid, E. Oechsle, M.G. Monaghan, H. Walles, F. Groeber-Becker, Cross-linked Collagen Hydrogel Matrix Resisting Contraction To Facilitate Full-Thickness Skin Equivalents, ACS Applied Materials & Interfaces 9(24) (2017) 20417-20425.
[14] L. Dong, Q. Liu, Y. Gao, H. Jia, W. Dai, L. Guo, H. Fan, Y. Fan, X. Zhang, The effect of collagen hydrogels on chondrocyte behaviors through restricting the contraction of cell/hydrogel constructs, Regenerative Biomaterials 8(4) (2021) rbab030.
[15] M. Dabaghi, N. Saraei, M.B. Carpio, V. Nanduri, J. Ungureanu, M. Babi, A. Chandiramohan, A. Noble, S.D. Revill, B. Zhang, K. Ask, M. Kolb, Y. Shargall, J. Moran-Mirabal, J.A. Hirota, A Robust Protocol for Decellularized Human Lung Bioink Generation Amenable to 2D and 3D Lung Cell Culture, Cells 10(6) (2021) 1538.
[16] Y. Deng, A. Shavandi, O.V. Okoro, L. Nie, Alginate modification via click chemistry for biomedical applications, Carbohydrate Polymers 270 (2021) 118360.
[17] M. Hirano, Y. Kakita, K. Ohmaru, S. Kurita, Structure and Mechanical Properties of the Vocal Fold1 1A portion of this article was presented at the Vocal Fold Physiology Conference, Kurume, Japan, in January 1980, in: N.J. Lass (Ed.), Speech and Language, Elsevier1982, pp. 271-297.
[18] V. Beachley, G. Ma, C. Papadimitriou, M. Gibson, M. Corvelli, J. Elisseeff, Extracellular matrix particle–glycosaminoglycan composite hydrogels for regenerative medicine applications, Journal of Biomedical Materials Research Part A 106(1) (2018) 147-159.
[19] A.K. Miri, Mechanical Characterization of Vocal Fold Tissue: A Review Study, Journal of Voice 28(6) (2014) 657-667.
Crédit image : 1. Smashicons. (nd). Larynx Icons. Récupérée de https://www.flaticon.com/free-icons/larynx. 2. Freepik. (nd). Cell icons. Récupérée de https://www.flaticon.com/free-icons/cell.
