
MRM Insights: Rajeunissement transcriptionnel de cellules souches musculaires âgées

Darren Blackburn

Vahab Soleimani
Chaque mois, dans les MRM Insights, un membre du Réseau MRM écrit sur les cellules souches et la médecine régénérative d’un point de vue différent. Ce mois-ci, le Dr Vahab Soleimani, Professeur agrégé au Département de génétique humaine de McGill et chercheur à l’Institut Lady Davis, et Darren Blackburn, candidat au doctorat dans son laboratoire, nous parlent du rajeunissement transcriptionnel de cellules souches musculaires agées.
Rajeunissement transcriptionnel de cellules souches musculaires âgées par un environnement de niche jeune
Le muscle squelettique sain a une puissante capacité de régénération en raison de la présence d’une petite population de cellules souches musculaires (MuSC) qui assurent le maintien et la réparation à vie du tissu. Les MuSC, comme les autres cellules dans le corps, n’existent pas dans le vide; Leur santé et leur fonction sont dictées non seulement par leurs propriétés intrinsèques, mais aussi par les interactions qu’elles ont avec leur environnement de niche. L’environnement de niche dans lequel résident les MuSC joue un rôle essentiel dans leur fonction. La niche englobe de nombreuses cellules non myogéniques telles que les progéniteurs fibro-adipogéniques (FAP), les macrophages, les cellules endothéliales et les fibroblastes, entre autres, qui se sont révélés importants dans la régulation de la quiescence, de la prolifération et de la différenciation des MuSC1-4. En plus des cellules résidentes, l’environnement de niche est également affecté par des facteurs systémiques provenant de la circulation sanguine ainsi que des composants structurels tels que les myofibres et la composition de la matrice extracellulaire (MEC)5-8.
Le vieillissement a un effet négatif considérable sur les muscles squelettiques et, par conséquent, sur l’environnement de niche des MuSC en raison de l’augmentation de l’inflammation, de la fibrose, de l’infiltration de graisse et de l’atrophie musculaire qui apparaîssent lors du vieillisement. Ces altérations dans le muscle perturbent la diaphonie entre les MuSC et les cellules voisines, conduisant à une rupture du soutien des MuSC par la niche9-11. Historiquement, les expériences de parabiose ont montré que l’exposition de muscles âgés à de jeunes facteurs circulatoires peut restaurer la capacité de régénération des muscles âgés12, démontrant l’effet que les facteurs extrinsèques peuvent avoir sur la fonction des MuSC.
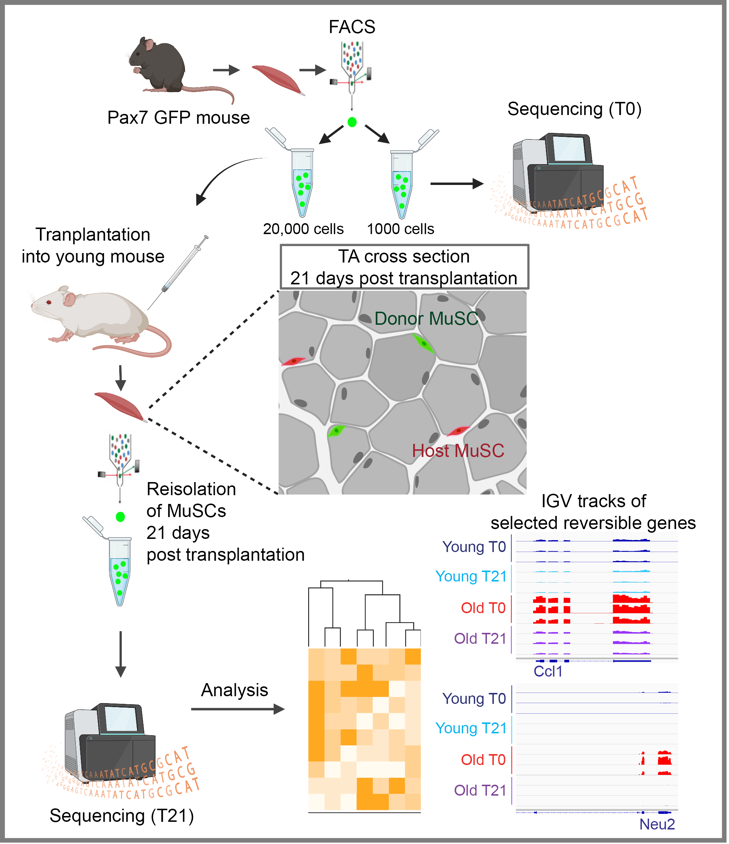
Figure 1: Schéma du modèle de transplantation utilisé dans l’étude. Créé avec Biorender.com
Dans une étude récente, nous avons adopté une approche à plusieurs volets utilisant la génomique unicellulaire et avons analysé l’effet du vieillissement sur la dynamique de la population, l’épigénome et le transcriptome des MuSC13. L’analyse des données scRNA-seq a montré que la perte de cellules souches musculaires liée à l’âge n’est pas aléatoire et que des sous-populations spécifiques sont préférentiellement perdues chez les souris âgées. Fait intéressant, les sous-populations qui sont retenues chez les souris âgées augmentent l’expression de la réponse au stress et des gènes antioxydants. Cette découverte suggère que l’activation des gènes antioxydants et de réponse au stress peut permettre à ces cellules de survivre dans un environnement musculaire âgé.
Pour déterminer si l’expression génique altérée par l’âge est réversible, nous avons conçu un modèle de greffe de cellules souches musculaires in vivo dans lequel nous avons isolé des MuSC marquées GFP chez d’anciens donneurs et les avons transplantées dans le muscle squelettique de jeunes souris hôtes13. Les MuSC greffées ont eu trois semaines rejoindre la niche et se remettre à l’état de quiescence. Les cellules greffées ont été ensuite isolées à nouveau et leur transcriptome entier a été analysé par RNA-seq. Il est frappant de constater qu’environ la moitié des gènes modifiés par l’âge ont été restaurés (rajeunis transcriptionnellement) à la suite d’une exposition à un environnement de niche jeune. La réversibilité du transcriptome des MuSC suggère que le ciblage de l’environnement de niche peut être une future avenue thérapeutique importante pour restaurer la réparation musculaire endogène médiée par les cellules souches dans le vieillissement et d’autres conditions de fonte musculaire.
Bien que cette étude fournisse un nouvel aperçu critique du rôle de l’environnement de niche dans la régulation de l’expression des gènes des MuSC, de nombreuses questions fondamentales restent sans réponse. Par exemple, quels facteurs dans l’environnement de niche jeune agissent comme des éléments rajeunissants ? De plus, le vieillissement entraîne également une altération significative de l’accessibilité de la chromatine et de la méthylation de l’ADN; La jeune niche épigénétiquement peut-elle rajeunir les MuSC âgées ? En d’autres termes, les altérations de la chromatine liées à l’âge peuvent-elles être restaurées par une exposition à la niche ? En outre, l’extension de cette analyse aux cellules non myogéniques du muscle squelettique pour étudier leur rajeunissement transcriptionnel potentiel par un environnement de niche jeune peut identifier des facteurs communs ou des voies biologiques qui peuvent être utilisés comme cibles moléculaires pour améliorer la régénération musculaire.
Pour en savoir plus sur ce sujet, consultez l’article récemment publié par le Laboratoire Soleimani et leurs collaborateurs dans Nature Comms: Transcriptional reprogramming of skeletal muscle stem cells by the niche environment.
Références
1 Biferali, B., Proietti, D., Mozzetta, C. & Madaro, L. Fibro–Adipogenic Progenitors Cross-Talk in Skeletal Muscle: The Social Network. Frontiers in Physiology 10 (2019). https://doi.org:10.3389/fphys.2019.01074
2 Joe, A. W. et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nat Cell Biol 12, 153-163 (2010). https://doi.org:10.1038/ncb2015
3 Verma, M. et al. Muscle Satellite Cell Cross-Talk with a Vascular Niche Maintains Quiescence via VEGF and Notch Signaling. Cell Stem Cell 23, 530-543 e539 (2018). https://doi.org:10.1016/j.stem.2018.09.007
4 Ratnayake, D. et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature 591, 281-287 (2021). https://doi.org:10.1038/s41586-021-03199-7
5 Li, H. et al. Muscle-secreted granulocyte colony-stimulating factor functions as metabolic niche factor ameliorating loss of muscle stem cells in aged mice. The EMBO Journal 38, e102154 (2019). https://doi.org:10.15252/embj.2019102154
6 Gilbert, P. M. et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science 329, 1078-1081 (2010). https://doi.org:10.1126/science.1191035
7 Garg, K. & Boppart, M. D. Influence of exercise and aging on extracellular matrix composition in the skeletal muscle stem cell niche. J Appl Physiol (1985) 121, 1053-1058 (2016). https://doi.org:10.1152/japplphysiol.00594.2016
8 Oh, J. et al. Age-associated NF-κB signaling in myofibers alters the satellite cell niche and re-strains muscle stem cell function. Aging (Albany NY) 8, 2871-2896 (2016). https://doi.org:10.18632/aging.101098
9 Ancel, S., Mashinchian, O. & Feige, J. N. Adipogenic progenitors keep muscle stem cells young. Aging 11, 7331-7333 (2019). https://doi.org:10.18632/aging.102304
10 Lukjanenko, L. et al. Aging Disrupts Muscle Stem Cell Function by Impairing Matricellular WISP1 Secretion from Fibro-Adipogenic Progenitors. Cell Stem Cell 24, 433-446.e437 (2019). https://doi.org:https://doi.org/10.1016/j.stem.2018.12.014
11 Lukjanenko, L. et al. Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice. Nat Med 22, 897-905 (2016). https://doi.org:10.1038/nm.4126
12 Conboy, I. M. et al. Rejuvenation of aged progenitor cells by exposure to a young systemic environment. Nature 433, 760-764 (2005). https://doi.org:10.1038/nature03260
13 Lazure, F. et al. Transcriptional reprogramming of skeletal muscle stem cells by the niche environment. Nat Commun 14, 535 (2023). https://doi.org:10.1038/s41467-023-36265-x
