MRM Insights : comment la neurogenèse postnatale modifie la fonction de l’hippocampe

Wei-Hsiang Huang

Max Kowalczyk
Chaque mois, dans les MRM Insights, un membre du Réseau de médecine régénérative de McGill offre une perspective unique sur les sujets des cellules souches et de la médecine régénérative. Dans cette édition, le Dr Wei-Hsiang Huang, professeur adjoint au Département de neurologie et de neurochirurgie au Centre de recherche en neurosciences (CRN), collabore avec Max Kowalczyk, un doctorant de son laboratoire. Ensemble, ils se plongent dans l’exploration de la manière dont la neurogenèse postnatale modifie la fonction hippocampique dans la santé et la maladie.
Comprendre comment la neurogenèse postnatale modifie la fonction de l’hippocampe dans la santé et la maladie.
La neurogenèse postnatale est un composant intégral de l’ontogenèse et de la plasticité neuronales, caractérisée par la génération continue de nouveaux neurones à partir de cellules souches neuronales tout au long de la vie d’un organisme. Chez les mammifères, la neurogenèse postnatale a été documentée dans plusieurs régions du cerveau, notamment dans l’hippocampe et plus précisément dans la zone sous-ventriculaire du gyrus denté [1,2]. L’ajout de nouveaux neurones adultes nouvellement formés (les cellules granulaires du gyrus dentés ou dGC) confère une plasticité structurale et fonctionnelle au circuit tri-synaptique de l’hippocampe grâce aux caractéristiques de connectivité des dGC adultes immatures [3,4]. Depuis sa découverte et sa confirmation, la neurogenèse adulte de l’hippocampe a été impliquée dans de multiples rôles physiologiques, notamment dans les processus cognitifs tels que l’apprentissage, la mémoire et la flexibilité cognitive. Les maladies contribuant à la dysrégulation de ce groupe de niches de cellules souches ont été associées à des troubles neurologiques (tels que la démence clinique, la schizophrénie, la dépression et les troubles bipolaires), à des altérations cognitives et à l’épilepsie du lobe temporal [5-7]. Qui plus est, bon nombre de ces maladies sont associées à l’hyperactivité de la voie de la kinase cible de la rapamycine chez les mammifères (mTOR), une cascade de signalisation cellulaire qui régule le processus de croissance et de développement neuronaux [8,9].
L’hyperactivation de mTOR est une caractéristique de la sclérose tubéreuse, un trouble du développement multisystémique causé par des mutations dans les gènes TSC1 ou TSC2. Bien qu’il y ait un chevauchement important dans les phénotypes cliniques résultant des mutations TSC1 et TSC2, des preuves suggèrent que les mutations TSC2 sont plus fréquemment détectées et entraînent des phénotypes neurologiques plus sévères. Parmi les pathologies caractéristiques de la sclérose tubéreuse, notamment les tubérosités corticales et les hamartomes bénins, les aspects les plus invalidants sont liés au handicap neurologique [10]. Près de 90 % des patients atteints de sclérose tubéreuse développent de l’épilepsie dès la petite enfance, de nombreux cas devenant intractables [11]. De plus, près de 50 % des patients souffrent de déficience intellectuelle, de troubles cognitifs et de troubles du spectre autistique (TSA) [8]. La sclérose tubéreuse est classée comme une « mTORopathie » car elle affecte la voie mTOR, qui joue un rôle essentiel dans la croissance cellulaire et le métabolisme en réponse aux facteurs de croissance, au stress, à l’énergie et aux nutriments [12]. De plus, la voie mTOR est un composant central de boucles de rétroaction positives, qui favorisent l’activité du réseau en réprimant les synapses inhibitrices sur les neurones excitateurs [12]. Alors que l’activité excessive de la voie mTOR dans les dGC nouvellement formées après la naissance contribue à l’épileptogenèse, on ignore encore dans quelle mesure l’hyperactivité de la vois mTOR due à Tsc régule la susceptibilité aux crises et provoque des dysfonctionnements cognitifs [13-15].
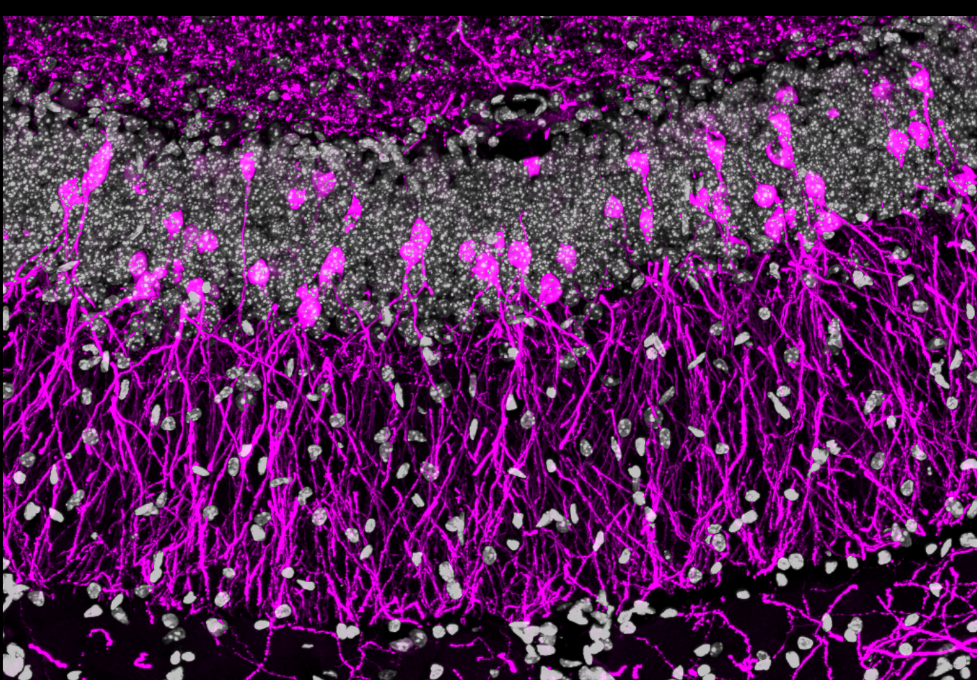
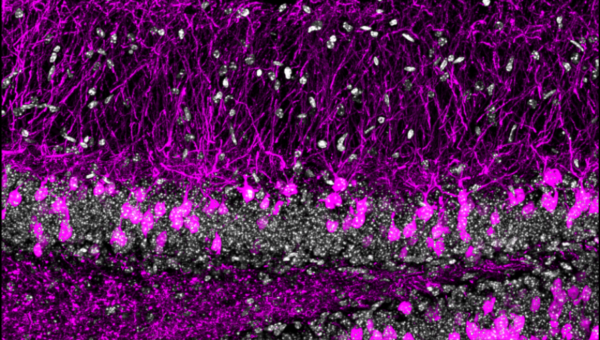
Figure 1 : Immunomarquage montrant des sections de l’hippocampe colorées au DAPI (gris), ainsi que des dGCs adultes nouvellement formées marquées par fluorescence dans une lignée de souris rapportrice (magenta).
Les modèles murins de l’activité de la voie mTOR ont montré que la suppression généralisée de Tsc1/2 dans les populations gliales ou neuronales présente des phénotypes neurocognitifs. En revanche, il a été démontré que l’hyperactivité de mTOR au sein des cellules de l’hippocampe peut provoquer de l’épilepsie [16]. Bien que ces études mettent en évidence que la perte pan-neuronale ou pan-gliale de Tsc peut avoir des effets neurocognitifs et que l’hyperactivité de mTOR peut causer des anomalies des dGC de l’hippocampe, l’impact de Tsc2 sur la neurogenèse postnatale des dGC reste inconnu. Pour évaluer le rôle de Tsc2 sur la structure et la fonction des dGC nouvellement formées chez l’adulte, nous utilisons une approche de suppression conditionnelle contrôlée temporellement pour supprimer spécifiquement Tsc2 dans les dGC nouvellement formées chez l’adulte et découvrir comment l’activité de mTOR pendant le développement des cellules souches neuronales postnatales affecte la fonction des réseaux sains existants. Nous examinons ensuite le rôle de Tsc2 dans la croissance cellulaire et la morphologie des dGC nouvellement formées chez l’adulte et évaluons comment une suppression conditionnelle de Tsc2 affecte la cognition et la susceptibilité aux crises chez les modèles murins. Nous explorons également l’influence des complexes mTOR clés (mTORC1 et mTORC2) sur la signalisation moléculaire et voyons si l’un ou l’autre peut être manipulé pour rééquilibrer la signalisation mTOR. Cela nous permettra également d’explorer une approche thérapeutique génétique pour potentiellement réguler l’hyperactivité de mTOR induite par Tsc2, qui est plus ciblée, car les options thérapeutiques actuelles reposent sur l’administration de la rapamycine, qui est inefficace pour traiter de nombreux phénotypes cognitifs et provoque de nombreux effets secondaires [10,17].
Nos travaux actuels suggèrent que l’expression de Tsc2 dans les dGC nouvellement formées chez l’adulte est essentielle pour réguler la signalisation neuronale, y compris l’activité de mTOR et l’activité de base du réseau. Nous observons également que l’expression de Tsc2 dans les dGC nouvellement formées chez l’adulte est importante pour divers aspects comportementaux, notamment la cognition, l’apprentissage et la mémoire, ainsi que la susceptibilité aux crises. Avec notre recherche en cours, cette approche ciblée nous permettra de mieux comprendre le rôle de Tsc2 dans l’influence de la signalisation cellulaire neuronale, de la morphologie et du comportement dans l’hippocampe. Elle révélera également comment la signalisation de Tsc2 au sein des dGC nouvellement formées chez l’adulte peut entraîner divers phénotypes observés chez les patients atteints de sclérose tubéreuse et déterminer dans quelle mesure ces cellules souches adultes contribuent aux symptômes similaires à la sclérose tubéreuse en influençant la fonction des réseaux neuronaux existants.
Références
1. Triarhou, L. C., & Manto, M. (2021). Postnatal neurogenesis beyond rodents: The groundbreaking research of Joseph Altman and Gopal Das. The Cerebellum, 21(1), 1–8.
2. Eriksson, P. S., Perfilieva, E., Björk-Eriksson, T., Alborn, A.-M., Nordborg, C., Peterson, D. A., & Gage, F. H. (1998). Neurogenesis in the adult human hippocampus. Nature Medicine, 4(11), 1313–1317.
3. Toda, T., Parylak, S. L., Linker, S. B., & Gage, F. H. (2018). The role of adult hippocampal neurogenesis in brain health and disease. Molecular Psychiatry, 24(1), 67–87.
4. Spalding, K. L., Bergmann, O., Alkass, K., Bernard, S., Salehpour, M., Huttner, H. B., Boström, E., Westerlund, I., Vial, C., Buchholz, B. A., Possnert, G., Mash, D. C., Druid, H., & Frisén, J. (2013). Dynamics of hippocampal neurogenesis in adult humans. Cell, 153(6), 1219–1227.
5. Burghardt, N. S., Park, E. H., Hen, R., & Fenton, A. A. (2012). Adult-born hippocampal neurons promote cognitive flexibility in mice. Hippocampus, 22(9), 1795–1808.
6. Hatami, M., Conrad, S., Naghsh, P., Alvarez-Bolado, G., & Skutella, T. (2018). Cell-biological requirements for the generation of dentate gyrus granule neurons. Frontiers in Cellular Neuroscience, 12.
7. Hattiangady, B., Rao, M., & Shetty, A. (2004). Chronic temporal lobe epilepsy is associated with severely declined dentate neurogenesis in the adult hippocampus. Neurobiology of Disease, 17(3), 473–490.
8. LaSarge, C. L., & Danzer, S. C. (2014). Mechanisms regulating neuronal excitability and seizure development following mTOR pathway hyperactivation. Frontiers in Molecular Neuroscience, 7.
9. Mizuguchi, M., Ohsawa, M., Kashii, H., & Sato, A. (2021). Brain symptoms of tuberous sclerosis complex: Pathogenesis and treatment. International Journal of Molecular Sciences, 22(13), 6677.
10. Karalis, V., Caval-Holme, F., & Bateup, H. S. (2021). Raptor Downregulation Rescues Neuronal Phenotypes in Mouse Models of Tuberous Sclerosis Complex.
11. Blair, J. D., Hockemeyer, D., & Bateup, H. S. (2018). Genetically engineered human cortical spheroid models of tuberous sclerosis. Nature Medicine, 24(10), 1568–1578.
12. Bateup, H. S., Johnson, C. A., Denefrio, C. L., Saulnier, J. L., Kornacker, K., & Sabatini, B. L. (2013). Excitatory/inhibitory synaptic imbalance leads to hippocampal hyperexcitability in mouse models of tuberous sclerosis. Neuron, 78(3), 510–522.
13. Arafa, S. R., LaSarge, C. L., Pun, R. Y. K., Khademi, S., & Danzer, S. C. (2019). Self-reinforcing effects of mtor hyperactive neurons on dendritic growth. Experimental Neurology, 311, 125–134.
14. LaSarge, C. L., Santos, V. R., & Danzer, S. C. (2015). PTEN deletion from adult-generated dentate granule cells disrupts granule cell mossy fiber axon structure. Neurobiology of Disease, 75, 142–150.
15. Pun, R. Y. K., Rolle, I. J., LaSarge, C. L., Hosford, B. E., Rosen, J. M., Uhl, J. D., Schmeltzer, S. N., Faulkner, C., Bronson, S. L., Murphy, B. L., Richards, D. A., Holland, K. D., & Danzer, S. C. (2012). Excessive activation of mTOR in postnatally generated granule cells is sufficient to cause epilepsy. Neuron, 75(6), 1022–1034.
16. Ehninger, D., de Vries, P. J., & Silva, A. J. (2009). From mtor to cognition: Molecular and cellular mechanisms of cognitive impairments in tuberous sclerosis. Journal of Intellectual Disability Research, 53(10), 838–851.
17. Kaplan, B., Qazi, Y., & Wellen, J. R. (2014). Strategies for the management of adverse events associated with mTOR inhibitors. Transplantation Reviews, 28(3), 126–133.
