MRM Insights : Cellules souches mésenchymateuses multipotentes – Essais cliniques thérapeutiques à McGill

Dre Marie Hudson

Dre Dominique Farge

Prof. James Martin

Dre Inés Colmegna
Chaque mois, dans les MRM Insights, un membre du Réseau de médecine régénérative de McGill offre une perspective unique sur les sujets des cellules souches et de la médecine régénérative. Dans cette édition, la Dre Inés Colmegna, Professeure agrégée à la Division de rhumatologie au sein de l’IR-CUSM s’est associée au Professeur James Martin, à la Dre Dominique Farge et la Dre Marie Hudson pour discuter des essais cliniques thérapeutiques utilisant des cellules stromales mésenchymateuses qui sont actuellement en cours à McGill.
Cellules souches mésenchymateuses multipotentes : Essais cliniques thérapeutiques à McGill
Inés Colmegna1, James Martin2, Dominique Farge3, Marie Hudson4
1 Division de rhumatologie, Centre universitaire de santé McGill (CUSM) et Institut de recherche du CUSM (IR-CUSM)
2 Division de pneumologie, Centre universitaire de santé McGill (CUSM) et Laboratoires Meakins-Christie, IR-CUSM
3 Département de médecine Interne, Université Paris & Division de Médecine Expérimentale, Université McGill
4 Division de rhumatologie, Hôpital Général Juif (HGJ) & Institut Lady Davis
Les cellules souches mésenchymateuses (CSM) sont des cellules multipotentes aux propriétés immunomodulatrices, proangiogéniques et antifibrotiques documentées in vitro et dans des modèles animaux. Sur cette base, les CSM ont été fréquemment testées dans des essais cliniques. La plupart des essais cliniques portant sur les CSM sont de petite envergure, de phase précoce, non contrôlés et visant un large éventail de maladies inflammatoires, principalement des affections musculosquelettiques, neurologiques et cardiovasculaires. Ces essais diffèrent dans leur conception, leur source de tissu (moelle osseuse, tissu adipeux et cordon ombilical), le compte rendu de la caractérisation du produit (c’est-à-dire l’identité cellulaire, la pureté, la puissance, la viabilité ou les tests fonctionnels) et la manipulation (soit la composition du milieu de cryopréservation, le véhicule de livraison, le temps de conservation après décongélation et jusqu’à l’administration, la voie d’administration et la durée de l’infusion). En conséquence, bien que les thérapies à base de CSM se soient avérées être systématiquement sans danger, les effets des CSM dans les essais cliniques se sont montrés variables et souvent moins bénéfiques que dans les études précliniques. Plusieurs recommandations ont été formulées pour maximiser les effets thérapeutiques des CSM et comprendre la biologie sous-jacente de leurs mécanismes d’action potentiels. Celles-ci comprennent l’amélioration de la publication des essais cliniques portant sur les CSM avec une terminologie et une nomenclature normalisées, des détails sur la préparation et l’analyse du produit expérimental, y compris la définition de la source cellulaire et de sa fabrication (soit la normalisation du produit à base de cellules de l’expansion à la livraison), la caractérisation objective des populations cellulaires administrées aux patients et des critères d’inclusion bien définis. La divulgation adéquate et transparente de ces caractéristiques devrait conduire à des études cliniques reproductibles et améliorer la crédibilité globale du domaine de la thérapie cellulaire. Suite à ces recommandations, au cours des deux dernières années, les deux premiers essais cliniques utilisant des CSM à McGill ont commencé le recrutement. Les deux études sont des essais cliniques initiés par des chercheurs, utilisant des CSM dérivées du cordon ombilical et conçues en collaboration avec des collègues cliniciens et statisticiens du centre de référence en thérapie cellulaire, Paris Cité MATHEC à l’hôpital St-Louis, Université Paris-Cité.
ProTrans19+ (NCT04869397) utilise des CSM pour le traitement des complications respiratoires associées à la COVID-19. Cette étude a testé l’hypothèse que les effets anti-inflammatoires, immunomodulateurs et pro-réparateurs des CSM allogéniques de la gelée de Wharton (CSM-GW) seraient sûrs et amélioreraient l’état clinique des adultes atteints de complications respiratoires associées à l’infection par la COVID-19. ProTrans19+ était un essai clinique randomisé de phase II, en double aveugle, contrôlé par placebo, visant à évaluer l’efficacité d’une seule perfusion intraveineuse d’une dose fixe de ProTrans® (100 millions de CSM par patient) dans le traitement de la pneumonie associée à la COVID-19 « grave ». Cette pathologie correspond aux patients qui n’atteignent pas une saturation en oxygène > 96 % sous 4 L/min d’O2 et qui n’étaient pas sous ventilation « non invasive », ventilation mécanique invasive ou ECMO. Tous les participants ont reçu ce qui était considéré comme un traitement standard pour la COVID au moment de leur inscription (par exemple, la dexaméthasone, la thérapie antivirale, la thérapie anti-cytokinique). De plus, les patients dans le groupe actif une seule perfusion intraveineuse de CSM-GW allogéniques (ProTrans®). ProTrans® contenait des CSM ex vivo expansées provenant de 5 donneurs et au 3e passage. Le produit était fourni cryopréservé par NextCell Pharma, et les sacs cryogéniques étaient décongelés au chevet du patient avant l’administration. Le résultat principal de l’étude était un critère composite défini par le taux d’utilisation de la ventilation mécanique (c’est-à-dire la nécessité d’une intubation) ou de décès à 15 jours après l’inclusion. ProTrans19+ a testé un certain nombre de critères secondaires (c’est-à-dire l’évolution clinique, la survie, le délai d’amélioration clinique, la durée de l’hospitalisation et le séjour en soins intensifs) ainsi que des analyses mécanistes exploratoires. L’étude a recruté dix-neuf patients sur deux sites (le site MUHC-Glen et le HGJ). ProTrans19+ a été interrompu car il n’était pas possible de démontrer l’effet escompté, l’analyse de l’étude est en cours.
CARE-SSc (NCT04356287) est une étude monopôle (HGJ) utilisant des CSM pour le traitement de patients atteints de sclérodermie systémique sévère (aussi appelée sclérose systémique ou SSc). Cette étude teste l’hypothèse qu’une ou deux perfusions à 3 mois d’intervalle de CSM-WG sont sûres et efficaces pour le traitement d’adultes atteints de SSc sévère qui remplissent en outre deux autres critères : (1) une réponse inadéquate ou des événements indésirables nécessitant l’arrêt du traitement standard (généralement constitué de méthotrexate 25 mg par semaine en sous-cutané (ou selon la tolérance) et/ou de mycophénolate mofétil 2 à 3 g/j (ou selon la tolérance) pendant au moins 3 mois), et (2) une inéligibilité ou un refus de subir une greffe autologue de cellules souches hématopoïétiques. CARE-SSc est un essai clinique randomisé de phase I/II, en double aveugle, contrôlé par placebo. Il propose d’inscrire 18 patients atteints de SSc en 3 blocs successifs de 6 patients chacun. Les participants sont randomisés dans l’un des deux groupes de traitement ou dans un groupe placebo (soit un total de 6 patients par groupe). Dans chaque bloc, les 6 patients sont randomisés dans un ratio de 2:2:2 dans l’un des groupes suivants : placebo, 1 perfusion de CSM (mois 0) ou 2 perfusions de CSM (mois 0 et mois 3). Les deuxièmes perfusions de CSM sont effectuées uniquement en l’absence de réaction indésirable grave à un médicament (RIM). Les randomisations des blocs 2 et 3 sont échelonnées, permettant la détection des RIM avant l’inclusion de patients dans un bloc ultérieur. Par exemple, le deuxième bloc sera randomisé uniquement en l’absence de RIM un mois après la première perfusion des 6 patients du premier bloc, et de manière similaire pour le troisième bloc. Chaque perfusion de produit actif consiste en 1 million de CSM par kg. L’objectif principal de CARE-SSc est la sécurité, évaluée selon la classification Common Terminology Criteria for Adverse Events (CTCAE) v5.0. Le critère principal étant l’existence de RIM définies comme un événement indésirable lié au traitement de grade ≥ 3 CTCAE évalué un mois après chaque perfusion. L’objectif secondaire de cette étude est de rechercher des preuves d’un signal d’efficacité possible pour orienter les futures phases de ce programme de recherche clinique. Le principal critère d’efficacité est le score cutané modifié de Rodnan (mRSS), une mesure validée de la fibrose cutanée, calculée comme la différence entre le mois 12 (M12) et M0. En plus de l’efficacité, d’autres critères secondaires (par exemple, la qualité de vie, la mortalité, etc.) et des critères exploratoires mécanistes seront rapportés. Le produit est fourni cryopréservé par le Centre de thérapie cellulaire de l’Université médicale de Caroline du Sud, et les sacs cryogéniques sont décongelés au chevet du patient avant l’administration. Le recrutement de CARE-SSc est en cours, l’inscription du premier bloc de 6 patients a été achevée. Le Comité indépendant de contrôle des données (CICD, DSMB en anglais) a approuvé le début du recrutement pour le deuxième bloc.
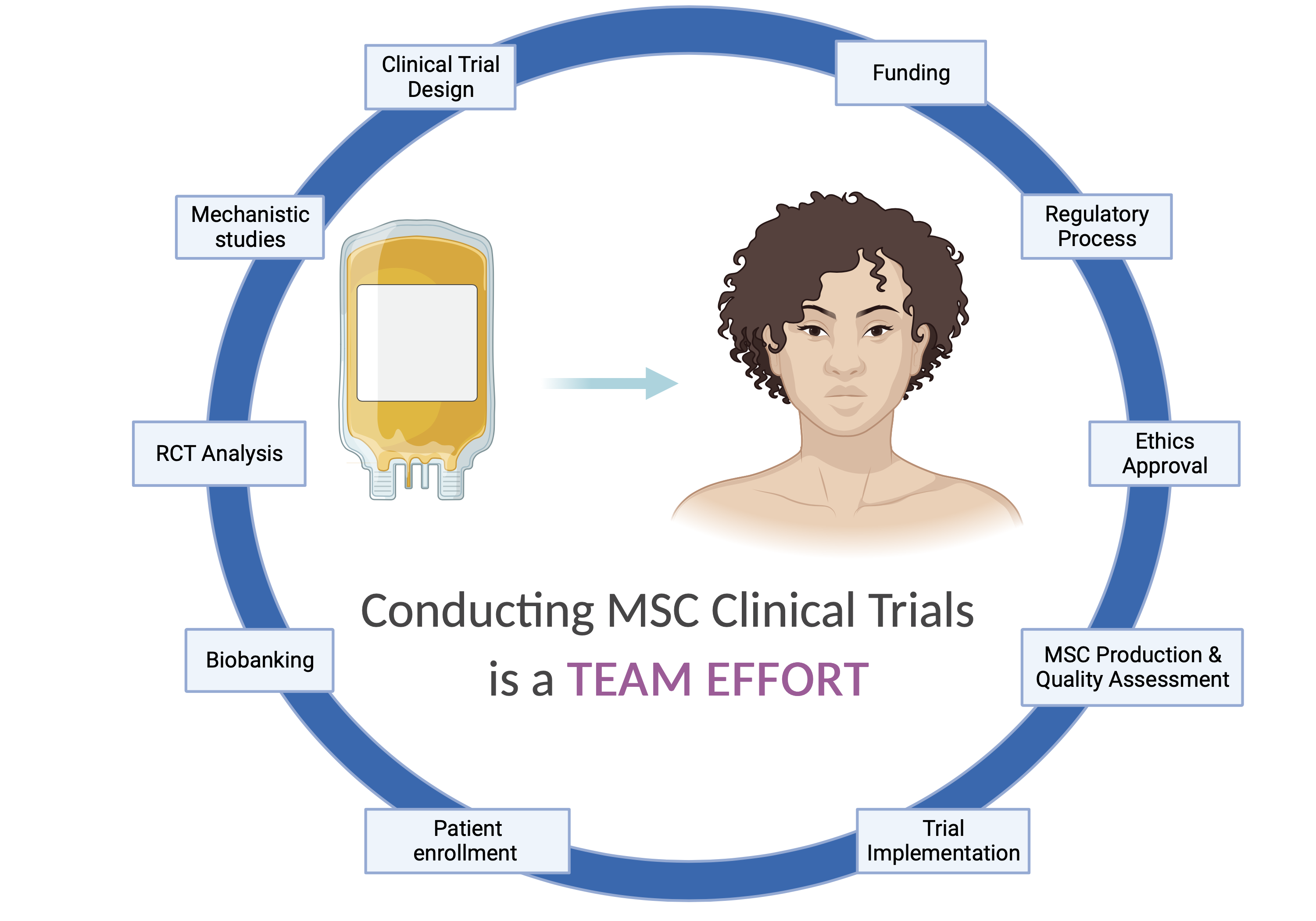
Ces deux essais cliniques sur les CSM, sans précédent à McGill, nous permettent maintenant de réfléchir à deux points : la faisabilité / les exigences pour la mise en œuvre d’essais cliniques sur les CSM et les prochaines étapes. ProTrans19+ et CARE-SSc sont une preuve de concept de la faisabilité de la réalisation d’essais cliniques sur les CSM à McGill. ProTrans19+ a été financé par la Fondation du CUSM et l’Institut Lady Davis, avec la contribution en nature de produits de CSM de NextCell Pharma. CARE-SSc a été financé par une subvention de fonctionnement des IRSC (Chercheuse principale : M. Hudson). Aucun de ces deux essais n’aurait pu être réalisé sans la contribution de nombreux collègues, dont certains ont une expertise unique dans d’autres types d’essais de thérapie cellulaire, et qui ont été/influent dans la conception, la mise en œuvre et l’analyse de ProTrans19+ et CARE-SSc. Un grand crédit doit aller aux Comités indépendants de contrôle des données (CICD des études, dirigés par le Dr Jean-Pierre Routy (ProTrans19+) et le Dr Jacques Galipeau (CARE-SSc). La réalisation d’essais de thérapie cellulaire nécessite un réel effort d’équipe et ne peut être réalisée sans avoir accès à des installations uniques telles que le Laboratoire de thérapie cellulaire (CTL) du CUSM, l’Unité de recherche clinique de l’HGJ et des collaborations internationales. L’environnement académique et collaboratif de McGill, associé à son expertise existante, à ses installations et à la confiance des participants, a permis de réaliser des essais cliniques sur les CSM.
Il est largement accepté que les résultats incohérents des essais cliniques sur les CSM, liés à la biologie sous-jacente des patients ou aux différences de procédures sur les sites d’essais, ont rendu difficile la réplication et la conclusion sur les avantages thérapeutiques des CSM. On a récemment suggéré que l’utilisation de métriques de stratification des patients couplée à la sélection de CSM thérapeutiquement puissantes (en utilisant des critères de qualité critiques rigoureux et/ou des produits CSM modifiés génétiquement) représente une voie pour améliorer les succès cliniques et les approbations réglementaires. Nous nous attendons à ce que, quel que soit leur résultat, ProTrans19+ et CARE-SSc nous apportent des informations mécanistes qui permettront d’optimiser les produits CSM et d’améliorer la sélection des patients qui pourraient en bénéficier. De plus, ces essais offrent des opportunités de mener des recherches fondamentales sur les mécanismes des effets des CSM et les biomarqueurs de la réponse au traitement. Ils contribueront également à la conception de futurs essais cliniques plus avancés visant à tester l’efficacité.
Références
1. Wilson, A.J., Rand, E., Webster, A.J. et al. Characterisation of mesenchymal stromal cells in clinical trial reports: analysis of published descriptors. Stem Cell Res Ther 12, 360 (2021).
2. Wiese D.M., Wood C.A., Braid L.R. From Vial to Vein: Crucial Gaps in Mesenchymal Stromal Cell Clinical Trial Reporting. Front Cell Dev Biol 10, 867426 (2022).
3. Galipeau J., Sensébé L. Mesenchymal Stromal Cells: Clinical Challenges and Therapeutic Opportunities. Cell Stem Cell 22, 824 (2018).
4. Robb K.P., Galipeau J., Shi Y., Schuster M., Martin I., Viswanathan S. Failure to launch commercially-approved mesenchymal stromal cell therapies: what’s the path forward? Proceedings of the International Society for Cell & Gene Therapy (ISCT) Annual Meeting Roundtable held in May 2023, Palais des Congrès de Paris, Organized by the ISCT MSC Scientific Committee. Cytotherapy:S1465-3249(23)01049-6 (2023).
